Feuer und Verbrennung
Das Feuer ist eine exotherme Reaktion, die viel Nutzen bringt, gerät es außer Kontrolle muss es mit Löschmitteln bekämpft werden.
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Bedeutung des Feuers
- Wann verbrennen Stoffe?
- Was passiert bei einem Brand?
- Löschmethoden
- Löschmittel und Brandklassen (A, B, C, D, F)
Bedeutung des Feuers
Das Feuer ist schon seit Urzeiten überaus wichtig für den Menschen. In der Steinzeit wurde das Feuer der Sippe immer gehütet und darauf geachtet, dass es nicht verlöscht. Dafür musste es immer mit brennbarem Material am Leben erhalten werden. Das Feuer war so derart wichtig, da es gefährliche Tiere in der Nacht fernhielt, Licht spendete, so dass man auch in der Dunkelheit arbeiten konnte, und eine Möglichkeit bot, Essen zu garen, und damit den Nährwert der Nahrung steigern konnte.

Feuer in der antiken Weltsicht
Feuer ist eines der vier antiken Elemente. Nach dem alten Glauben bestand alle Materie aus den vier Elementen Luft, Erde, Wasser oder Feuer oder einer Mischung dieser. Dabei war Feuer das zerstörerischste aller Elemente.
Phlogiston-Theorie
Im weiteren zeitlichen Verlauf kam die Phlogiston-Theorie auf. Diese besagte, dass alle brennbaren Stoffe das sogenannte Phlogiston beinhalten würden. Dieser Stoff sei es nämlich, der eigentlich brenne. Wenn das Phlogiston fehle, dann könne der Stoff auch nicht brennen. Das Phlogiston entweiche bei einer Verbrennung aus dem Brennstoff. Diese Theorie wurde widerlegt, als man feststellte, dass Stoffe nach der Verbrennung schwerer waren als vorher.
Wann verbrennen Stoffe?
Feuer hat auch heute noch etwas sehr Mystisches, aber wir verstehen die Abläufe und die Erscheinung des Feuers deutlich besser. Dem Feuer liegt eine exotherme Reaktion zugrunde. Dabei wird Energie frei. Diese Energie zeigt sich dann in Form von Wärme und Licht.
Es gibt drei Bedingungen für ein Feuer.
- Damit es zu einem Feuer kommt, muss ein brennbarer Stoff vorliegen. Brennen können alle Stoffe, die mit Sauerstoff reagieren.
- Jeder Stoff hat dabei eine ganz bestimmte Entzündungstemperatur. Damit es zu einem Feuer kommt, muss diese überschritten werden.
- Da jedes Feuer eine Reaktion mit Sauerstoff darstellt, muss auch immer genug Sauerstoff für die Verbrennung vorhanden sein.
Was passiert bei einem Brand?
Verbrennungsreaktionen sind immer exotherm. Bei dieser Reaktionsart weisen die Ausgangsstoffe (A+B) mehr Energie auf als die Reaktionsprodukte (C+D).
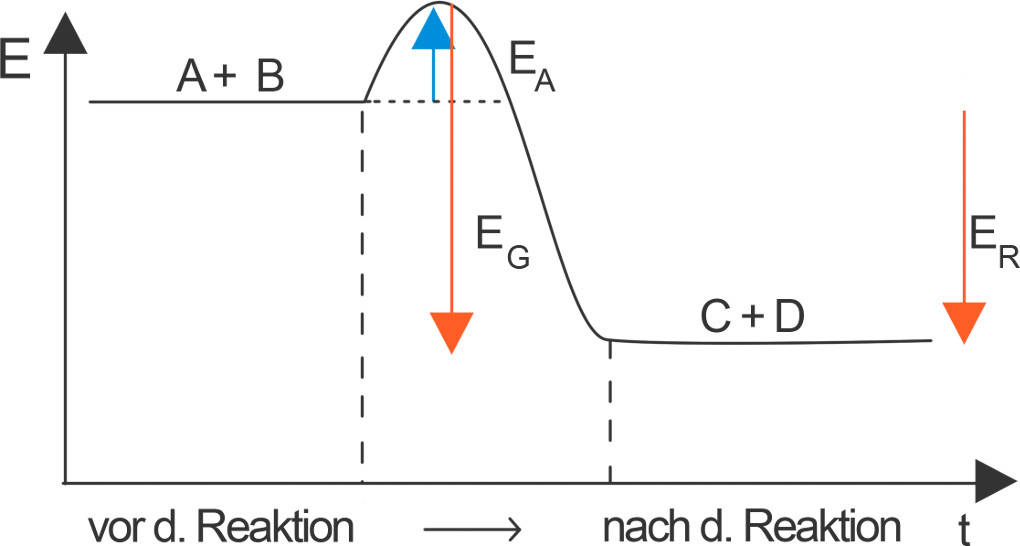
Die vorher als chemische Energie gespeicherte Energie wird durch die Reaktion als Wärme- und Lichtenergie frei. Damit wird die chemische Energie für uns nutzbar, z.B. zum Kochen oder zum Betreiben einer Dampfmaschine.
Löschmethoden
Um einen Brand zu löschen, muss man dem Feuer mindestens eine der Bedingungen entziehen. Die allgemeine Löschmethoden sind also
- der Entzug des brennbaren Materials,
- der Entzug von Sauerstoff und
- die Senkung der Temperatur unter die Entzündungstemperatur.
Löschmittel und Brandklassen (A, B, C, D, F)
Die einfachste und dennoch wirkungsvolle Löschmethode ist es, den brennenden Stoff vom Sauerstoff zu trennen. Man kann dies mithilfe eines dichten Tuches oder einer Löschdecke erreichen und so ein Feuer ersticken. Aber Achtung, dies funktioniert nur bei kleinen Bränden und ist die Methode, um brennende Personen zu löschen.
Daneben kennst ja sicher den Feuerlöscher. Viele dieser Brandbekämpfer hängen in der Schule und natürlich auch im Labor. Wenn ein Brand entsteht, kann man auf diese zurückgreifen, aber nur, wenn man geübt und dafür ausgebildet ist. Ansonsten muss die Feuerwehr gerufen werden. Es gibt viele unterschiedliche Varianten, im Alltagsgebrauch sind Schaum-, ABC-Pulver- und $CO_2$-Löscher am häufigsten anzutreffen. Jeder dieser Löscher ist auf bestimmte Brandklassen ausgerichtet. In dieser Tabelle haben wir ihre Wirkung auf Brände der unterschiedlichen Brandklassen mit Wasser als Löschmittel verglichen.
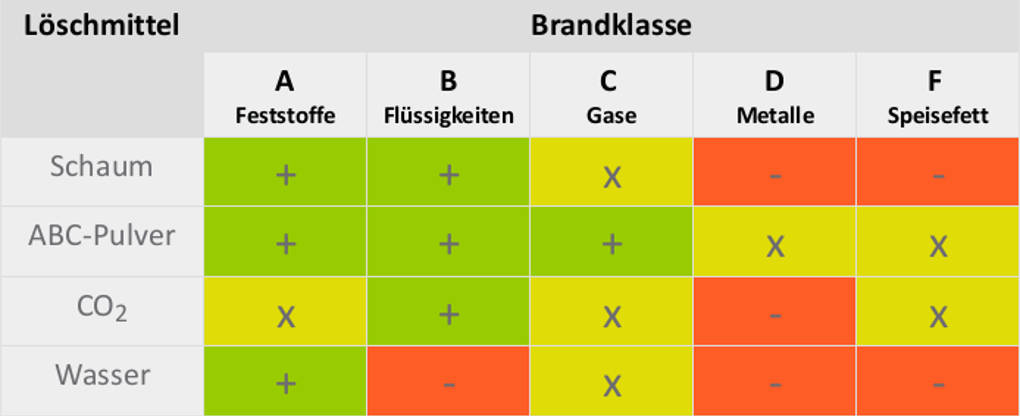
Legende: Grün: „ist geeignet“, gelb: „ist ungeeignet“, rot: „verschlimmert die Situation“.
Man sieht also, dass für den Hausgebrauch vermutlich der ABC-Pulverlöscher der vielseitigste Löscher ist, jedoch gibt es nach dem Einsatz viele Löschmittelrückstände. Der $CO_2$-Löscher arbeitet hingegen rückstandsfrei.
Wenn man elektrische Anlagen löschen möchte, ist darauf zu achten, dass man den Mindestabstand einhält. Früher gab es für Elektrobrände auch noch die Brandklasse E, diese wurde aber ersatzlos gestrichen, da Strom nicht selbst brennt.
Einen Sonderfall stellen die Metallbrände da. Diese brennen sogar in reinem Kohlenstoffdioxid und unter Wasser weiter, da sie dem Wasser oder dem Kohlendioxid den Sauerstoff entziehen. Diese Brände muss man mit trockenem Sand ersticken. Bei einem Magnesiumbrand hilft sogar Sand nur bedingt, da der Sand hier zu Glas reagiert. Magnesiumbrände löscht man daher am besten mit Salz.
Also entscheidet immer der brennende Stoff über die notwendige Löschmethode.
Brandschutz-Ausbildung und Feuerwehren
Falls du dich für die Brandbekämpfung interessierst, gibt es auch viele Jugendfeuerwehren, gerade im ländlichen Gebiet. Es gibt aber auch analog zur Ersthelferschulung Schulungen zum Brandbekämpfer.
Es gibt auch professionelle Brandbekämpfer, die zu Großbränden ausrücken. In Deutschland gibt es dafür die nebenberufliche freiwillige Feuerwehr und die hauptberufliche Berufsfeuerwehr.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Feuer und Verbrennung (5 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Feuer und Verbrennung (6 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation











 Feuer und Flamme – Stoffe verbrennen
Feuer und Flamme – Stoffe verbrennen
 Was ist eine Verbrennung?
Was ist eine Verbrennung?
 Brennstoffe und Verbrennungsprodukte
Brennstoffe und Verbrennungsprodukte
 Verbrennung und Sauerstoff
Verbrennung und Sauerstoff
 Löschmethoden
Löschmethoden
 Aktivierungsenergie und Reaktionsenergie am Beispiel der Kerze
Aktivierungsenergie und Reaktionsenergie am Beispiel der Kerze









