Ester
In der Chemie bilden Ester eine eigene Stoffklasse, die durch die Reaktion einer Säure mit einem Alkohol entstehen. Es gibt organische und anorganische Ester. Sie finden in verschiedenen Bereichen Anwendung und kommen auch in der Natur vor, z.B. in Obst und Gewürzen. Wie die hergestellt werden, und was für Eigenschaften haben sie, lernst du im folgenden Artikel!
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Ester
Ester – Definition
Spricht man von Estern, sind in der Regel die Carbonsäureester gemeint. Es gibt aber auch Ester, die aus anorganischen Säuren gebildet werden.
Die Ester bilden eine eigene Stoffklasse in der Chemie. Hergestellt werden sie durch die Reaktion einer Säure mit einem Alkohol. Dabei kann es sich bei der Säure um eine anorganische Säure (z. B. Salpetersäure oder Schwefelsäure) oder um eine organische Säure (z. B. Essigsäure oder Buttersäure) handeln. Häufig werden jedoch organische Säuren, die sogenannten Carbonsäuren, eingesetzt. Dabei bilden sich die Carbonsäureester, die in den Naturwissenschaften die größte Gruppe der Ester bilden
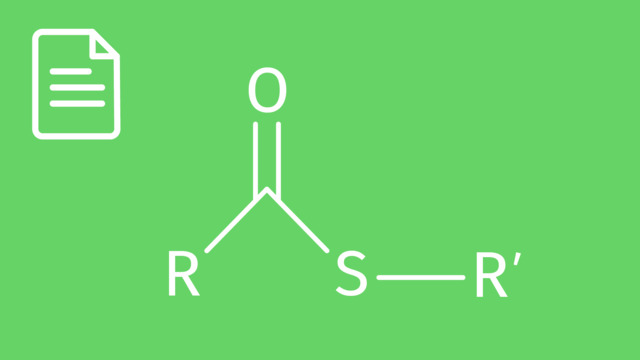
Die funktionelle Gruppe der organischen Ester bildet sich durch die Verbindung der funktionellen Gruppen der Alkohole $\left( \ce{-OH} \right)$ und der Carbonsäuren $\left( \ce{-COOH} \right)$ heraus.
Die organischen Ester haben alle eine gemeinsame Struktur. Diese wird in der vereinfachten Strukturformel häufig als $\ce{ R1-(C=O)-O-R2}$ oder $\ce{R1-COO-R2}$ geschrieben.
Die funktionelle Gruppe der Ester hat demnach die Struktur $\ce{-COO}-$. Du siehst sie in der folgenden Abbildung rot dargestellt.
Auf der linken Seite ist die allgemeine Strukturformel der Ester abgebildet, auf der rechten Seite siehst du ein konkretes Beispiel: Propansäuremethylester. Dieser Ester wurde aus
Zunächst wollen wir auf die Regeln zur Benennung der Ester – also die Nomenklatur – eingehen.
Kennst du das?
Vielleicht hast du schon einmal bemerkt, dass der Duft eines frisch gepflückten Apfels besonders intensiv ist. Dieser frische, fruchtige Geruch kommt unter anderem von Estern, die natürlicherweise in Früchten vorkommen.
Estern verdanken wir die wunderbaren Aromen, die Obst so verlockend machen. Jedes Mal, wenn du an einem Apfel riechst, nimmst du also einen Hauch von Chemie wahr!
Ester – Nomenklatur
Es gibt mehrere Möglichkeiten, Ester in der organischen Chemie zu benennen.
Die erste Möglichkeit haben wir schon in der obigen Abbildung gesehen. Beim Beispiel Propansäuremethylester haben wir den Namen der Säure (Propansäure) dem Namen des Alkylrestes des Alkohols
Die zweite Möglichkeit der Benennung folgt der Systematik der IUPAC-Nomenklatur. Demnach bekommen Esterverbindungen die
Die funktionelle Gruppe der Ester hat in den meisten Fällen Vorrang vor anderen funktionellen Gruppen und bildet damit fast immer die Wortendung einer organischen Verbindung. Nur wenn es noch zusätzliche
Die dritte Möglichkeit bezieht sich darauf, einen Ester als Salz der entsprechenden Carbonsäure zu betrachten. Demnach ist der Alkylrest mit der
Diese Art der Benennung wird insbesondere dann verwendet, wenn die
Manche Carbonsäuren haben auch Trivialnamen – zum Beispiel
Trotz des Vergleichs mit anorganischen Salzen ist zu beachten, dass in organischen Salzen bzw. Estern keine ionischen Bindungen vorliegen. Das
Fehleralarm
Achtung! Ester und Ether sind nicht das Gleiche! Ester werden in der Regel aus Säuren und Alkoholen gebildet, Ether entstehen oft aus zwei Alkoholen. Dementsprechend unterscheiden sich auch die funktionellen Gruppen der beiden Stoffklassen.
In der folgenden Tabelle haben wir noch einmal die unterschiedlichen Möglichkeiten der Benennung verschiedener Esterverbindungen zusammengefasst.
| Alkohol | Carbonsäure | Carbonsäureester | IUPAC-Name | Carboxylat-Bezeichnung |
|---|---|---|---|---|
| Methanol | Propansäure | Propansäuremethylester | Methylpropionat | Methylpropancarboxylat |
| $\ce{CH3-OH}$ | $\ce{CH3-CH2-COOH}$ | $\ce{CH3-CH2-COO-CH3}$ | $\ce{CH3-CH2-COO-CH3}$ | $\ce{CH3-CH2-COO-CH3}$ |
| Methanol | Benzoesäure | Benzoesäuremethylester | Methylbenzoat | Methylbenzolcarboxylat |
| $\ce{CH3-OH}$ | $\ce{C6H5-COOH}$ | $\ce{C6H5-COO-CH3}$ | $\ce{C6H5-COO-CH3}$ | $\ce{C6H5-COO-CH3}$ |
| Methanol | Ethansäure (Essigsäure) | Essigsäuremethylester | Methylethanoat | Methylacetat |
| $\ce{CH3-OH}$ | $\ce{CH3-CH2-COOH}$ | $\ce{CH3-COO-CH3}$ | $\ce{CH3-COO-CH3}$ | $\ce{CH3-COO-CH3}$ |
| Methanol | Ameisensäure | Ameisensäuremethylester | Methylmethanoat | Methylformiat |
| $\ce{CH3-OH}$ | $\ce{HCOOH}$ | $\ce{HCOO-CH3}$ | $\ce{HCOO-CH3}$ | $\ce{HCOO-CH3}$ |
| Ethanol | Ameisensäure | Ameisensäureethylester | Ethylmethanoat | Ethylformiat |
| $\ce{CH3-CH2-OH}$ | $\ce{HCOOH}$ | $\ce{HCOO-CH2-CH3}$ | $\ce{HCOO-CH2-CH3}$ | $\ce{HCOO-CH2-CH3}$ |
Daneben gibt es noch
Historisch bedingt leitet sich die Bezeichnung Ester von dem Wort Äther ab. Genauer gesagt handelt es sich um eine verkürzte Form der Bezeichnung Essigäther. So wurde im 19. Jahrhundert die wichtigste Esterverbindung Essigsäureethylester (Ethylacetat) genannt.
Ester – Eigenschaften
Die organischen Ester werden nach ihren Kettenlängen in zwei Gruppen eingeteilt. Von den Fruchtestern spricht man bei kurzkettigen Estern. Langkettige Ester werden hingegen als Fette oder Öle bezeichnet. Die Fette und Öle bestehen aus einem Dreifachalkohol (in der Regel Glycerin) sowie langkettigen Alkansäuren (sogenannten Fettsäuren), die an den Dreifachalkohol gebunden sind. Im Alltag werden dir häufig Fruchtester begegnen, die einen fruchtigen, obstartigen Geruch haben.
Einige gemeinsame Eigenschaften der Ester wollen wir hier einmal festhalten:
- Ester haben eine geringere Dichte als Wasser. Deshalb schwimmen beispielsweise Fette und Öle immer an der Wasseroberfläche.
- Die Moleküle der Ester sind nur gering polar. Deshalb sind Ester nur schlecht bis gar nicht in Wasser löslich. Auch das kennst du bestimmt schon von verschiedenen Ölen.
- Mit zunehmender Kettenlänge nimmt die Löslichkeit in Wasser immer weiter ab. Fruchtester sind also etwas besser wasserlöslich als Fette und Öle. Umso besser sind letztere hingegen in unpolaren Lösungsmitteln wie Benzin löslich.
- Die Schmelz- und Siedetemperaturen der Ester sind relativ niedrig, was direkt auf die geringe Polarität der Moleküle zurückzuführen ist.
- Bei Raumtemperatur und Normaldruck sind die meisten Ester flüssig. Besonders langkettige Ester sind fest. Diese werden auch Wachse genannt.
- Ester sind leicht entzündlich und gut brennbar, denn sie sind flüchtig, d. h. sie gehen relativ leicht in die Gasphase über.
- Vor allem die Fruchtester haben einen fruchtigen, obstartigen Geruch. In vielen Früchten sind Fruchtester enthalten.
- Manche Ester haben auch eine narkotische, also betäubende Wirkung oder können die Atemwege reizen, wenn sie in hoher Konzentration eingeatmet werden.
Die wichtigsten Eigenschaften haben wir auch noch einmal in der folgenden Tabelle zusammengefasst:
| Eigenschaft | Ausprägung |
|---|---|
| Aggregatzustand | flüssig (unter Normalbedingungen) |
| Siedebereich | niedrig siedend |
| Polarität | gering polar (Fette und Öle praktisch unpolar) |
| Löslichkeit | schlecht in Wasser löslich, gut in Benzin löslich |
| Farbe | farblos |
| Geruch | fruchtig, obstartig (insbesondere Fruchtester) |
| Verwendung | Lösemittel (z. B. in Nagellackentferner oder für Klebstoff), Aromastoff, Brennstoff uvm. |
| Gefahren | leicht entzündlich, manche narkotisierend oder reizend |
Ester – Struktur
Im Folgenden wollen wir genauer auf die Molekülstruktur der Ester eingehen. Wir haben bereits gelernt, dass wir die allgemeine Struktur eines Esters mit der Formel $\ce{R1-COO-R2}$, oder genauer $\ce{ R1-(C=O)-O-R2}$, ausdrücken können. Die funktionelle Gruppe der
Die Carbonylgruppe ist polar, wirkt sich aber vor allem in Kombination mit längeren Alkylresten nur gering auf die Polarität des gesamten Moleküls aus.
Carbonsäureester
Die meisten Ester sind Carbonsäureester, also Ester, die aus einer organischen Säure
- Carbonsäureester sind rein organische Verbindungen.
- Carbonsäureester werden aus organischen Säuren
(z. B. Ameisensäure, Essigsäure, Propansäure, …) und einem Alkohol(z. B. Methanol, Ethanol, Propanol, …) oder auchPhenol $\left( \ce{C6H5-OH} \right)$ gebildet. - Carbonsäureester können mit der allgemeinen Strukturformel bzw.
Halbstrukturformel $\ce{ R1-(C=O)-O-R2}$ dargestellt werden.
Die Reaktionsgleichung der Bildung eines Carbonsäureesters lässt sich wie folgt formulieren:
$\begin{array}{ccccccc} \text{Carbonsäure} & & \text{Alkohol} & & \text{Carbonsäureester} & & \text{Wasser} \\[4pt] \ce{R1-(C=O)-OH} & + & \ce{R2-OH} & \longrightarrow & \ce{R1-(C=O)-O-R2} & + & \ce{H2O} \end{array}$
Für unserer vorheriges Beispiel Propansäuremethylester würde die Gleichung entsprechend so aussehen:
$\begin{array}{cccc} \text{Propansäure} & & \text{Methanol} & \\[4pt] \ce{CH3-CH2-\color{red}{(C=O)-OH}} & + & \ce{CH3-\color{blue}{OH}} & \longrightarrow \\[8pt] \text{Propansäuremethylester} & & \text{Wasser} & \\[4pt] \ce{CH3-CH2-\color{red}{(C=O)}-\color{blue}{O}-CH3} & + & \ce{H2O} & \end{array}$
Das Wassermolekül $\left( \ce{H2O} \right)$ wird durch die Abspaltung der
Ester anorganischer Sauerstoffsäuren
Anstelle von organischen Carbonsäuren können Ester auch mit anorganischen Säuren gebildet werden, wenn diese Sauerstoff enthalten.
- Ester anorganischer Sauerstoffsäuren werden manchmal anorganische Ester genannt, zählen aber eigentlich auch zu den organischen Verbindungen.
- Solche Ester werden aus anorganischen Sauerstoffsäuren
(z. B. Phosphorsäure, Schwefelsäure, Salpetersäure, …) und einem Alkohol(z. B. Methanol, Ethanol, Propanol, …) oder auchPhenol $\left( \ce{C6H5-OH} \right)$ gebildet. - Die Ester anorganischer Sauerstoffsäuren können mit der allgemeinen Strukturformel $\ce{ X-O-R}$ dargestellt werden, wobei $\ce{R}$ der Alkylrest des Alkohols ist und $\ce{X}$ ein bestimmter Säurerest der jeweiligen Sauerstoffsäure.
Wie der Säurerest $\ce{X}$ bei Phosphorsäureestern, Schwefelsäureestern und Salpetersäureestern genau aussieht, sehen wir uns im Folgenden an.
Phosphorsäureester
Phosphorsäureester sind Ester der
| Phosphorsäure | Phosphat-Ion |
|---|---|
 |
 |
| $\ce{H3PO4}$ | $\ce{PO4^{3-}}$ |
Vereinfacht lässt sich die Phosphorsäure mit der
$\begin{array}{ccccccc} \text{Phosphorsäure} & & \text{Alkohol} & & \text{Phosphorsäureester} & & \text{Wasser} \\[4pt] \ce{(OH)2-\color{red}{(P=O)-OH}} & + & \ce{R-\color{blue}{OH}} & \longrightarrow & \ce{(OH)2-\color{red}{(P=O)}-\color{blue}{O}-R} & + & \ce{H2O} \end{array}$
Im Prinzip läuft die Bildung des Phosphorsäureesters also genau wie bei den Carbonsäuren ab, wobei das Phosphoratom den Platz des Kohlenstoffs der Carboxygruppe $\left( \ce{-\color{red}{(P=O)-OH}} \right)$ einer Carbonsäure einnimmt. Auch hier findet eine Wasserabspaltung statt.
Da die Phosphorsäure allerdings über drei
Dementsprechend hat der Säurerest $\ce{X}$ in unserer allgemeinen
Schwefelsäureester
Schwefelsäureester sind Ester der
| Schwefelsäure |
|---|
 |
| $\ce{H2SO4}$ |
Die Schwefelsäure lässt sich vereinfacht mit der
$\begin{array}{ccccccc} \text{Schwefelsäure} & & \text{Alkohol} & & \text{Schwefelsäureester} & & \text{Wasser} \\[4pt] \ce{OH-\color{red}{(SO2)-OH}} & + & \ce{R-\color{blue}{OH}} & \longrightarrow & \ce{OH2-\color{red}{(SO2)}-\color{blue}{O}-R} & + & \ce{H2O} \end{array}$
Neben der Bildung des gezeigten Monoesters mit der allgemeinen
Salpetersäureester
Salpetersäureester sind Ester der
| Salpetersäure |
|---|
 |
| $\ce{HNO3}$ |
Auch in diesem Fall können wir die Säure vereinfacht mit der
$\begin{array}{ccccccc} \text{Salpetersäure} & & \text{Alkohol} & & \text{Salpetersäureester} & & \text{Wasser} \\[4pt] \ce{\color{red}{(NO2)-OH}} & + & \ce{R-\color{blue}{OH}} & \longrightarrow & \ce{\color{red}{(NO2)}-\color{blue}{O}-R} & + & \ce{H2O} \end{array}$
Der
Allerdings wollen wir bei den Salpetersäureestern noch auf eine weitere Möglichkeit der Veresterung eingehen. Eine Säure kann nämlich auch mit einem Mehrfachalkohol reagieren.
Ein typisches Beispiel ist der Dreifachalkohol
 |
| $\ce{C3H5(-OH)3}$ |
Jede der
$\begin{array}{cccc} \text{Glycerin} & & \text{Salpetersäure} & \\[4pt] \ce{C3H5(-\color{blue}{OH})3} & + & \ce{3 \color{red}{(NO2)-OH}} & \longrightarrow \\[8pt] \text{Trisalpetersäureglycerinester} & & \text{Wasser} & \\[4pt] \ce{C3H5(-\color{blue}{O}-\color{red}{NO2})3} & + & \ce{3 H2O} & \end{array}$
Die Verbindung Trisalpetersäureglycerinester (oder auch Glycerintrinitrat) kennst du vielleicht schon unter dem Trivialnamen Nitroglycerin. Das ist ein bekannter Sprengstoff. In der folgenden Abbildung siehst du die Reaktion noch einmal etwas deutlicher dargestellt. Dabei wirkt Schwefelsäure als Katalysator.
| Reaktion von Glycerin und Salpetersäure |
|---|
 |
Die räumliche Struktur des Nitroglycerins kann auch noch etwas genauer dargestellt werden. In der folgenden Abbildung siehst du zwei Darstellungen, die die dreiseitige Struktur des Moleküls verdeutlichen. Diese ergibt sich aus der Anordnung der entgegengesetzten Formalladungen der
| Nitroglycerin (Trisalpetersäureglycerinester) | |
|---|---|
 |
 |
| Vereinfachte Molekülstruktur | Darstellung mit Formalladungen |
In der folgenden Tabelle sind noch einmal die allgemeinen Halbstrukturformeln der Monoester, Diester und Triester der gezeigten anorganischen Sauerstoffsäuren aufgelistet.
| allgemeine Formel | Phosphorsäureester | Schwefelsäureester | Salpetersäureester |
|---|---|---|---|
| $\ce{ X-O-R}$ (Monoester) | $\ce{(OH)2-(P=O)-O-R}$ | $\ce{OH-(SO2)-O-R}$ | $\ce{(NO2)-O-R}$ |
| $\ce{ X-(O-R)2}$ (Diester) | $\ce{OH-(P=O)-(O-R)2}$ | $\ce{(SO2)-(O-R)2}$ | |
| $\ce{ X-(O-R)3}$ (Triester) | $\ce{(P=O)-(O-R)3}$ |
Nun wollen wir noch die Ester der anorganischen Säuren (am Beispiel der Salpetersäure) mit den Carbonsäureestern vergleichen. Dabei gehen wir in der folgenden Tabelle auch auf die dreifachen Ester des Glycerins ein (die sogenannten Triglyceride), von denen wir das mit der Salpetersäure gebildete Nitroglycerin bereits kennengelernt haben.
| allgemeine Formel | Carbonsäureester | Salpetersäureester |
|---|---|---|
| $\ce{ X-O-R}$ (Monoester) | $\ce{R1-(C=O)-O-R2}$ | $\ce{(NO2)-O-R}$ |
| $\ce{C3H5(-O-X)3}$ (Triglyceride) | $\ce{C3H5(-(C=O)-O-R)3}$ | $\ce{C3H5(-O-NO2)3}$ |
Die Triglyceride, die aus verschiedenen Carbonsäuren mit den Alkylresten $\ce{R}$ gebildet werden können, werden auch Tryacylglycerole genannt. Du kennst sie unter dem deutlich einfacheren Begriff Fette.
Übung zur Struktur und Nomenklatur der Ester
Benenne die abgebildeten Esterverbindungen:
| $\ce{CH3-(C=O)-O-CH3}$ | $\ce{CH3-O-(SO2)-O-CH3}$ | $\ce{CH3-(C=O)-O-C4H9}$ |
|---|---|---|
 |
 |
 |
Es sind mehrere verschiedene Namen möglich. Wir haben sie in einer kleinen Tabelle zusammengefasst:
| $\ce{CH3-(C=O)-O-CH3}$ | $\ce{CH3-O-(SO2)-O-CH3}$ | $\ce{CH3-(C=O)-O-C4H9}$ |
|---|---|---|
| Essigsäuremethylester | Schwefelsäuredimethylester | Essigsäure-tert-butylester |
| Methylethanoat | Dimethylsulfat | 1,1-Dimethylethylethanoat |
| Methylacetat | Dimethylsulfat | tert-Butylacetat |
Ester – Vorkommen
Ester begegnen dir im Alltag oft, ohne dass du es weißt. Viele der Lebensmittel, die du täglich zu dir nimmst, enthalten von Natur aus Ester. Besonders in Obst kommen Ester häufig vor. Den Butansäuremethylester findest du beispielsweise unter anderem in Ananassen, Äpfeln sowie Erdbeeren. Weitere natürliche Quellen für Fruchtester sind unter anderem:
- Lebensmittel wie beispielsweise Honig und Käse,
- Genussmittel wie Wein und Rum,
- Gewürze wie Zimt,
- Blüten und Blätter wie Jasmin, Kiefer, Lavendel und Salbei.
Auch mit den synthetisch hergestellten Estern wirst du sicherlich im Alltag schon einmal Kontakt gehabt haben. Essigsäureethylester wird zum Beispiel in Nagellackentfernern eingesetzt und ist in vielen Klebstoffen vorhanden.
Aber auch Fette und Öle findest du oft im Alltag. Olivenöl, Sonnenblumenöl oder auch Kokosöl enthalten solche Ester. Noch langkettigere Ester findest du aber auch in Bienenwachs wieder.
Der wohl bekannteste anorganische Ester ist Nitroglycerin. Es handelt sich hierbei um einen Ester, der aus dem dreiwertigen Alkohol Glycerin und Salpetersäure zusammengesetzt ist. Nitroglycerin, das chemisch korrekt als Glycerinnitrat (bzw. Glycerintrinitrat) oder auch Trisalpetersäureglycerinester bezeichnet wird, ist für die Explosivität von Dynamit verantwortlich. Wie dieser Ester genau aufgebaut ist, haben wir uns weiter oben schon im Detail angesehen.
Wusstest du schon?
Ester können sogar in Medizinprodukten helfen. Zum Beispiel wird Aspirin aus Salicylsäure und Essigsäure hergestellt, wobei ein Ester entsteht (AAS = Acetylsalicylsäure). Diese Verbindung hilft, Schmerzen zu lindern und Fieber zu senken. Also, wenn du das nächste Mal eine Kopfschmerztablette nimmst, denk daran, dass ein kleines Ester‑Molekül dir Erleichterung verschafft!
Ester – Herstellung
Ester lassen sich durch die Reaktion einer Säure mit einem Alkohol herstellen. Zur Herstellung der Ester können unterschiedliche Alkohole mit unterschiedlichen Carbonsäuren kombiniert werden. Hierdurch ergibt sich eine Vielzahl an unterschiedlichen Strukturen der Ester.
Wird eine anorganische Säure (beispielsweise die Phosphorsäure) eingesetzt, bildet sich ein sogenannter anorganischer Ester (beispielsweise ein Phosphorsäureester). Da neben dem Ester bei der Reaktion auch Wasser freigesetzt wird, handelt es sich bei der Esterbildung um eine Kondensationsreaktion.
Wie die verschiedenen Reaktionen mit unterschiedlichen Säuren aussehen, haben wir weiter oben schon betrachtet, als wir uns mit den Strukturen verschiedener Ester befasst haben.
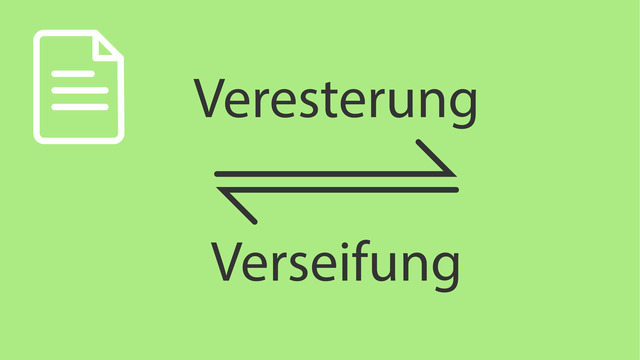
Veresterung
Die Bildung eines Esters aus einer Säure und einem Alkohol wird Veresterung (der Säure) genannt. Die folgende Gleichung ist eine allgemeine Darstellung der Veresterung einer Carbonsäure der
$\begin{array}{ccccccc} \text{Carbonsäure} & & \text{Alkohol} & & \text{Carbonsäureester} & & \text{Wasser} \\[4pt] \ce{R1-\color{red}{(C=O)-OH}} & + & \ce{R2-\color{blue}{OH}} & \longrightarrow & \ce{R1-\color{red}{(C=O)}-\color{blue}{O}-R2} & + & \ce{\color{red}{H-O}-\color{blue}{H}} \end{array}$
Die Veresterung einer anorganischen Säure wollen wir uns noch einmal am Beispiel der Phosphorsäure in Erinnerung rufen:
$\begin{array}{ccccccc} \text{Phosphorsäure} & & \text{Alkohol} & & \text{Phosphorsäureester} & & \text{Wasser} \\[4pt] \ce{(OH)2-\color{red}{(P=O)-OH}} & + & \ce{R-\color{blue}{OH}} & \longrightarrow & \ce{(OH)2-\color{red}{(P=O)}-\color{blue}{O}-R} & + & \ce{\color{red}{H-O}-\color{blue}{H}} \end{array}$
Für die Bildung der organischen Ester ist in der Regel ein Katalysator notwendig. Hierfür wird meist eine starke anorganische Säure eingesetzt. Die Veresterung durch diese sogenannte Säurekatalyse wird auch Fischer-Veresterung genannt.
Im Zusammenhang mit der Herstellung von Estern wirst du auch oft auf die Begriffe Verseifung und Hydrolyse stoßen. Was diese beiden Begriffe bedeuten, wollen wir nun klären.
Hydrolyse
Die Hydrolyse ist die Umkehrreaktion der Kondensationsreaktion. Da es sich bei der Veresterung um eine Kondensationsreaktion handelt, ist mit Hydrolyse in diesem Zusammenhang die Umkehrreaktion der Veresterung – also die Spaltung eines Esters – gemeint. Eine entsprechende, allgemein formulierte Reaktionsgleichung der Hydrolyse eines Carbonsäureesters sieht demnach so aus:
$\begin{array}{ccccccc} \text{Carbonsäureester} & & \text{Wasser} & & \text{Carbonsäure} & & \text{Alkohol} \\[4pt] \ce{R1-\color{red}{(C=O)}-\color{blue}{O}-R2} & + & \ce{\color{red}{H-O}-\color{blue}{H}} & \longrightarrow & \ce{R1-\color{red}{(C=O)-OH}} & + & \ce{R2-\color{blue}{OH}} \end{array}$
Hierbei wird also durch die Einbindung eines
Verseifung
Mit Verseifung ist im Prinzip nichts anderes als die Hydrolyse eines Esters gemeint. Während Hydrolyse der allgemeine Begriff für die Umkehrreaktion einer Kondensationsreaktion ist, bezieht sich der Begriff Verseifung direkt auf die Umkehrung einer Veresterung.
Sehen wir uns also nochmal die Reaktionsgleichung der Spaltung eines Esters an – in diesem Fall mit einem konkreten Beispiel, dem Essigsäureethylester:
$\begin{array}{cccc} \text{Essigäureethylester} & & \text{Wasser} & \\[4pt]\ce{CH3-\color{red}{(C=O)}-\color{blue}{O}-CH2-CH3} & + & \ce{\color{red}{H-O}-\color{blue}{H}} & \longrightarrow \\[8pt] \text{Essigsäure} & & \text{Ethanol} & \\[4pt] \ce{CH3-\color{red}{(C=O)-OH}} & + & \ce{CH3-CH2-\color{blue}{OH}} & \end{array}$
Der Begriff Verseifung bezieht sich darauf, dass eine solche Reaktion bei der Herstellung von Seifen aus Fetten zum Einsatz kommt. Fette sind, wie wir bereits gesehen haben, Esterverbindungen von Glycerin mit bestimmten Carbonsäuren, den sogenannten Fettsäuren. Die Verseifung von Fetten geht allerdings über die Abspaltung der jeweiligen Fettsäuren hinaus, denn aus diesen werden im Anschluss Salze gebildet, zum Beispiel durch die Verbindung mit Natrium-Ionen $\left( \ce{Na+} \right)$. Eine Seife ist also das Salz einer Fettsäure. Dieses wird durch die Verseifung aus einem Fett gewonnen.
Am Ende einer Verseifung liegt die entsprechende Carbonsäure also in Form ihres
$\begin{array}{cccc} \text{Carbonsäureglycerinester (Fett)} & & \text{Natronlauge} & \\[4pt] \ce{C3H5(-O-(C=O)-R)3} & + & \ce{3 NaOH} & \longrightarrow \\[8pt] \text{Natriumcarboxylat (Seife)} & & \text{Glycerin} & \\[4pt] \ce{3 [Na^{+}R-(C=O)-O^{-}]} & + & \ce{C3H5(-OH)3} & \end{array}$
In der folgenden Abbildung haben wir noch einmal Hin- und Rückreaktion der Veresterung bzw. Hydrolyse für das Beispiel Essigsäureethylester dargestellt:
Allerdings trifft der Begriff Verseifung streng genommen für die Umkehrreaktion nur dann zu, wenn die Essigsäure am Ende in Form des
Die säurekatalysierte Veresterung und die saure Hydrolyse bilden eine Gleichgewichtsreaktion:
$\ce{R1-\color{red}{(C=O)-OH} + R2-\color{blue}{OH}} \xrightleftharpoons{\ce{H+}} \ce{R1-\color{red}{(C=O)}-\color{blue}{O}-R2 + \color{red}{H-O}-\color{blue}{H}}$
In beide Richtungen findet ein mehrschrittiger Prozess statt, wobei mehrfach
Ester – Verwendung in der Industrie
In der chemischen Industrie werden sowohl Fruchtester als auch Fette, Öl und Wachse verwendet und weiterverarbeitet. Dabei können die Esterverbindungen aus Pflanzen gewonnen werden, insbesondere aus deren Früchten und Ölen, oder auch künstlich hergestellt werden, durch die Veresterung einer Säure mit einem Alkohol.
Im Folgenden sehen wir uns einige Anwendungen von solchen industriell hergestellten oder verarbeiteten Estern an.
Aromastoffe
Das fruchtige, süße Aroma von Früchten ist heute in vielen Lebensmitteln zu finden. Das ist unter anderem auf Esterverbindungen zurückzuführen. Diese werden entweder in ihrer natürlichen Form (natürliche Aromen) zugesetzt oder künstlich hergestellt (künstliche Aromen). So kann der Geschmack von beliebten Obstsorten oder Beeren imitiert werden. Beispielsweise riecht Essigsäurepentylester nach Banane und und Buttersäuremethylester nach Ananas.
Die künstlich hergestellten Estermoleküle unterscheiden sich dabei nicht von den natürlich vorkommenden, aber oft lässt sich dennoch ein kleiner geschmacklicher Unterschied feststellen, da am Geschmack bzw. Aroma einer echten Frucht noch einige andere Moleküle beteiligt sind, die den Gesamteindruck beeinflussen.
Als Duftstoffe werden Ester außerdem nicht nur in Lebensmitteln, sondern auch in der Parfümindustrie eingesetzt.
Fette und Biodiesel
Langkettige Ester wie Fette, Öle und Wachse werden ebenfalls in der Lebensmittelindustrie eingesetzt, können aber auch als Schmierstoffe oder Brennstoffe verwendet werden. Wir können in diesem Zusammenhang wieder zwischen natürlich und künstlich hergestellten Ölen bzw. Estern unterscheiden. Natürliche Fette sind aus langkettigen Carbonsäuren (den sogenannten Fettsäuren) und dem Alkohol Glycerin zusammengesetzt. Das sind die sogenannten Triglyceride, die wir weiter oben schon besprochen haben. Künstliche Fette, Öle und Wachse werden meist aus einzelnen Bestandteilen von Erdöl synthetisiert.
Eine besondere Rolle spielen Ester im Biodiesel. Das ist ein Kraftstoff, der ausschließlich aus pflanzlichen (und damit nachwachsenden) Rohstoffen hergestellt wird. Hier sind es natürliche Fettsäuren, die mit Methanol zu Fettsäuremethylestern verarbeitet werden. Solche Ester werden als FAME bezeichnet, abgeleitet von der englischen Bezeichnung fatty acid methyl ester, und bilden den Hauptbestandteil von Biodiesel.
Lösungsmittel
Viele Ester sind bei Raumtemperatur flüssig. Die funktionelle Gruppe der Ester weist zwar eine geringe Polarität auf, aber aufgrund der oft langkettigen Alkylreste sind die meisten Ester trotzdem im Wesentlichen unpolar. Damit sind sie gut als Lösungsmittel für unpolare Stoffe geeignet und werden zum Beispiel in Klebstoffen eingesetzt.
Kunststoffe
Einzelne Estermoleküle können auch miteinander verknüpft werden und so extrem lange Molekülketten bilden. Solche Molekülketten nennt man Polymere. Kunststoffe sind nichts anderes als Polymere – und eine ganz bekannte Gruppe von Kunststoffen sind die Polyester.
In der Abbildung siehst du einen einfachen Polyester, bei dem sich das Molekül der Propansäure immer wieder wiederholt, was durch die
| Einfache Darstellung eines Polyesters |
|---|
 |
Es gibt aber noch deutlich mehr Polyester mit verschiedenen Molekülstrukturen, die auch noch weitere funktionelle Gruppen enthalten können. Am bekanntesten ist wahrscheinlich Polyethylenterephthalat, abgekürzt PET, das aus Ethylenglycol und Terephthalsäure zusammengesetzt wird.
Wichtig bei der Bildung eines Polyesters ist, dass der Alkohol über
Polyester findest du in synthetischen Textilien, Plastikflaschen, Folien, Lacken und vielem mehr. Sie werden auch als sogenannte Weichmacher in anderen Kunststoffen eingesetzt, die selbst keine Polyester sind.
Fassen wir nochmal die wichtigsten Anwendungen der Ester zusammen:
- Fruchtester: natürliche Aromastoffe in Früchten, künstliche Aromen in verarbeiteten Lebensmitteln
- Fette: Nährstoffe in Lebensmitteln, Schmierstoffe in technischen Anwendungen
- Öle: Nährstoffe in Lebensmitteln, Schmierstoffe und Brennstoffe in technischen Anwendungen, Bestandteil von Biodiesel, außerdem unpolare Lösungsmittel
- Wachse: Brennstoffe in Kerzen
- Polyester: Kunststoffe für synthetische Textilien, Plastikflaschen, Folien, Lacke, als Weichmacher uvm.
Die Verwendung der Ester von anorganischen Sauerstoffsäuren unterscheidet sich teilweise deutlich von den Anwendungen der organischen Carbonsäureester:
- Einige Phosphorsäureester sind hochgiftig und können als Insektizide oder sogar als chemische Kampfstoffe eingesetzt werden.
- Bestimmte Schwefelsäureester werden als Tenside in Reinigungsmitteln verwendet.
- Viele Salpetersäureester sind explosiv, d. h. sie zersetzen sich explosionsartig. So dient beispielsweise Nitroglycerin (Glycerintrinitrat) als Sprengstoff im Dynamit. Die Verbindung kommt aber auch als Arzneistoff zum Einsatz.
Ausblick – das lernst du nach Ester
Vertiefe dein Wissen über Veresterung und Esterverseifung! Lerne außerdem Fette und Öle sowie Aromaten kennen und entdecke die spannenden Prozesse dieser organischen Verbindungen. Mache dich bereit, deine chemischen Kenntnisse auf ein neues Level zu heben!
Zusammenfassung der Ester
- Ester sind organische Verbindungen, die sich aus einer Säure und einem Alkohol zusammensetzen. Den Prozess zur Herstellung eines Esters nennt man Veresterung. Es handelt sich um eine Kondensationsreaktion.
- Ester, die auf organischen Säuren basieren, heißen Carbonsäureester (z. B. Essigsäureethylester, auch Ethylacetat). Sie werden von den Estern anorganischer Sauerstoffsäuren unterschieden (z. B. Trisalpetersäureglycerinester, auch Glycerintrinitrat).
- Ester werden auch nach ihrer Kettenlänge unterschieden. Kurzkettige Ester sind Fruchtester, die in Früchten vorkommen. Langkettige Ester sind Fette, Öle oder Wachse.
- Polyester sind Kunststoffe, die aus langen Ketten von Estermolekülen synthetisiert werden.
- Carbonsäureester kommen als Aromastoffe, Schmiermittel, Brennstoffe und als Kunststoffe in Textilen, Plastikflaschen und vielen anderen Anwendungen zum Einsatz.
Häufig gestellte Fragen zum Thema Ester
Transkript Ester
Hallo und herzlich willkommen. Dieses Video heißt Ester. Du kennst bereits Alkanole und Alkansäuren und vielleicht auch Alkohole und Carbonsäuren. Nachher kannst du über die Herstellung, Vorkommen, die Eigenschaften und die Verwendung von Estern berichten. Der Film besteht aus sechs Abschnitten: 1. Herstellung, 2. Verschiedene Ester, 3. Fette und Öle, 4. Ester aus anorganischen Säuren, 5. Einfache Carbonsäureester und 6. Zusammenfassung. 1. Herstellung: Die Ester sind eine Stoffklasse. Bei der Reaktion eines Alkohols mit einer Säure entsteht ein Ester und außerdem Wasser. Alkohole haben die Hydroxylgruppe OH. Bei den Alkoholen kann es sich um Alkanole handeln oder auch um andere Alkohole. Säuren können die Carboxylgruppe COOH enthalten. Das sind organische Säuren. Die einfachsten davon sind die Alkansäuren. Es gibt aber auch noch mehr organische Säuren. Der Überbegriff ist dann Carbonsäuren, aber auch anorganische Säuren können Ester bilden. Zum Beispiel die Schwefelsäure, H2SO4 oder die Salpetersäure HNO3. Mitunter benötigt man noch eine starke Säure als Katalysator. Und zwar immer dann, wenn Carbonsäuren reagieren. 2. Verschiedene Ester: Wir haben bereits gelernt, dass Ester durch Reaktion anorganischer Säuren entstehen können. Die meisten Ester jedoch entstehen aus Carbonsäuren. Diese enthalten die Carboxylgruppe COOH. Sowohl Fette als auch Öle sind Ester. Und schließlich gibt es einfache Carbonsäureester. 3. Fette und Öle: Beispiele für Fette und Öle sind Butter, Schmalz und Pflanzenöl. Hier haben wir die Formel für ein Fett. Der Ester hier enthält immer einen Dreifachalkohol, das Glycerin. Der zweite Bestandteil sind langkettige Säuren, meistens Alkansäuren, man nennt sie auch Fettsäuren. Aus beiden Bestandteilen entsteht ein Dreifachester unter Abspaltung von Wasser. 4. Ester aus anorganischen Säuren: Ein solcher Ester ist Hauptbestandteil des Dynamits. Umgangssprachlich sagt man Nitroglycerin, aber chemisch exakter ist es besser Glycerinnitrat zu sagen. Die chemische Formel sieht so aus. Der Alkohol ist das Glycerin. Die Säure ist die Salpetersäure. Dynamit ist ein Sprengstoff, meist für friedliche Zwecke. 5. Einfache Carbonsäureester: Hier gilt schon konkreter: Alkohol plus Carbonsäure reagieren zu Ester plus Wasser. Die Carbonsäure enthält nur eine einzige Carboxylgruppe, der Alkohol nur eine Hydroxylgruppe. Und hier ein Beispiel: C2H5OH plus CH3COOH reagieren zum entsprechenden Ester plus Wasser. Man benötigt eine starke Säure, häufig wird Schwefelsäure genommen. Wie heißen die beteiligten Verbindungen? Ethanol, Ethansäure und Ethylethanoat. Häufig nennt man den Ester Essigsäureethylester. Statt Ethanol kann man auch andere Alkohole verwenden, die Alkanole Propanol, Butanol oder Pentanol und so weiter. Und statt Ethansäure kann man Propansäure, Butansäure, Pentansäure und so weiter, verwenden. Und auch die kleinsten Moleküle kann man einsetzen: Methanol und Methansäure. Und noch ein Beispiel. Nehmen wir die Verbindungen ganz unten. Pentanol und Pentansäure bilden bei der chemischen Reaktion Pentylpentanoat. Man sagt dazu auch Valeriansäurepentylester. Alle Alkohole sind mit allen Säuren kombinierbar. Bei den Estern gibt es zwei Möglichkeiten. Sie können A; kurzkettig sein. Diese Ester nennt man Fruchtester. Sind die Ester langkettig, handelt es sich um Wachse. Beginnen wir mit A, Fruchtester. Das sind die Ester, die über relativ kurze Ketten verfügen. Und hier ein Vertreter. Butansäuremethylester. Er ist enthalten in Ananas, in Äpfeln und in Erdbeeren. Fruchtester sind flüssig, sie sind niedrig siedend, farblos und brennbar. Fruchtester haben einen obstartigen Geruch. Ihre Moleküle sind wenig polar. Daher sind sie mit Wasser schlecht mischbar. Gut mischbar sind sie mit wenig polaren Lösungsmitteln wie Benzin. Fruchtester sind daher gute Lösungsmittel. Durch den angenehmen Geruch kann man sie als Aromen einsetzen. Methylacetat findet man in Kleber. Ethylacetat ist in Nagellackentferner enthalten. Man benutzt Fruchtester als Lösungsmittel oder zur Verdünnung, für Nitrocellulose, Harze, Lacke und Farben. Wie schon der Name sagt, findet man Fruchtester zum Großteil in Früchten, in Aprikosen, Bananen, Birnen, Brombeeren sowie in Himbeeren, Kirschen, Orangen, Pfirsichen und Weintrauben und es gibt noch weitere Beispiele. Auch Blüten und Blätter enthalten Fruchtester. Zum Beispiel Jasmin, Kiefern, Lavendel und Salbei. Und auch in Lebensmitteln, Gewürzen und Genussmitteln findet man Fruchtester, in Honig, in Käse, in Pastinak, das ist eine Wurzel, im Zimt und sogar im Rum und im Wein sind Fruchtester. Kommen wir nun B zu den Wachsen. Hier ist das Molekül langkettig. Wichtige Beispiele sind Bienenwachs und Walrat aus dem Wal. Ein wichtiges Wachs ist Montanwachs. Man gewinnt es aus trockener Kohle. 6. Zusammenfassung: Ein Alkohol reagiert mit einer Säure zu einem Ester und Wasser. Der Ester kann einmal durch anorganische Säuren gebildet werden oder durch organische Säuren, die die Carboxylgruppe COOH enthalten. Hier unterscheidet man zwischen Fetten und Ölen, sowie einfachen Carbonsäureestern. Die einfachen Carbonsäureester unterteilt man in Fruchtester und Wachse. Fruchtester sind flüssig, brennbar, duftend und die Moleküle sind wenig polar. Man findet sie unter anderem in Obst und in Blüten. Verwendet werden sie für Aromen und als Lösungsmittel. Und zum Ende noch einen Blick auf die vielen Quellen der Fruchtester. Und schon wieder ist das Video aus. Ich wünsche euch alles Gute und viel Erfolg. Tschüss.
Ester Übung
-
Formuliere die allgemeine Herstellungsreaktion eines Esters.
TippsDei Veresterung ist eine Kondensationsreaktion.
Dabei wird Wasser frei.
LösungAusgangsstoffe für alle Ester sind ein Alkohol und eine Säure. Die OH-Gruppe des Alkohols reagiert also mit dem Proton der Säure und wird abgespalten. Es ergibt sich eine neue Bindung. Eine Ester-Gruppe ist entstanden: $\ce{-COO-}$. Ester haben vielfältige Erscheinungsformen. Es gibt flüssige, leichtflüchtige und auch wachsartige Ester. Sie kommen in Früchten, Fetten und vielen anderen Stoffen unseres Alltags vor. Aus Polyester, also Stoffen mit vielen Ester-Gruppen, bestehen Flaschen und auch Kleidung.
-
Gib die Verwendungsmöglichkeiten von Estern an.
TippsEster werden mitunter als Lösemittel eingesetzt.
Dynamit ist Glycerintrinitrat.
LösungEster besitzen eine Ester-Gruppe zwischen zwei organischen Resten. Es gibt kurzkettige und auch langkettige Ester. Sie besitzen verschiedene Eigenschaften und eignen sich daher für verschiedene Zwecke. Kurzkettige Ester dienen als Lösemittel in Lacken und Klebstoffen, aber auch als Aromastoff für z. B. Limonade.
Es gibt auch Ester aus anorganischen Säuren. Ein Beispiel dafür ist das Glycerintrinitrat. Im Volksmund wird es fälschlicherweise als Nitroglycerin bezeichnet. Dieser Stoff ist im von Alfred Nobel erfundenen Dynamit enthalten.
-
Benenne die Ester aus den gegebenen Ausgangsstoffen.
TippsDer Name ergibt sich aus der Säure, dem Rest des Alkohols und der Endung Ester.
Eine andere Form der Benennung setzt sich zusammen aus dem Rest des Alkohols und dem Carboxylat-Ion der Säure.
LösungDer Name eines Esters setzt sich immer aus den Edukten zusammen. Du kannst also immer von den Edukten auf das Produkt schließen und umgekehrt. Im Bild siehst du den Ester Ethansäureethylester. Dieser wird auch als Ethylacetat bezeichnet. Er ist aus der Reaktion von Essigsäure und Ethanol entstanden. Es handelt sich um einen kleinen, leichtflüchtigen Ester.
Reaktionsgleichung:
$\ce{C2H5OH + CH3-COOH -> C2H5-COO-CH3 + H2O}$ -
Beschreibe Fruchtester und ihr Vorkommen.
TippsDie Verwendung leitet sich aus den Eigenschaften ab und folgt daher am Ende.
Beginne mit dem Aufbau der Fruchtester.
LösungFruchtester sind kurzkettige Ester. Da ihre Moleküle relativ klein und wenig polar sind, bestehen keine hohen Anziehungskräfte innerhalb der Substanz. Es können also viele Moleküle aus der Oberfläche in die Gasphase eintreten. Daher sind Fruchtester leicht flüchtig und man riecht sie sehr deutlich, da sich viele Moleküle in der Luft befinden. Ethyl- und Butylacetat sind besonders wichtige Lösemittel in der Lackindustrie. Sie werden auch zum Säubern von Oberflächen eingesetzt. Butylacetat besitzt einen Geruch, der an Eisbonbons erinnert.
-
Beschrifte die Teile des gezeigten Fettes.
TippsGlycerin besitzt die Summenformel $\ce{C3H5(OH)3}$. Es ist also ein dreifacher Alkohol.
Fettsäuren sind lange Kohlenwasserstoffketten mit einer Säuregruppe.
LösungFette entstehen durch die Reaktion des Dreifachalkohols Glycerin mit drei Fettsäuren. Es bildet sich ein Dreifachester und Wasser wird abgespalten. Im Bild siehst du ein Beispiel für ein solches Molekül in Skelettschreibweise. Fette sind aufgrund der langen unpolaren Fettsäure-Reste nicht mit Wasser mischbar. Sie bilden einen Grundnährstoff und liefern dem Körper viel Energie. Die Fettsäuren, besonders die ungesättigten Fettsäuren, sind wichtig für den Aufbau körpereigener Stoffe.
-
Beschreibe die Seifenherstellung aus Fetten.
TippsBei der Verseifung handelt es sich um eine Hydrolyse.
Die saure Verseifung stellt die Rückreaktion der Esterherstellung dar. Die saure Verseifung ist daher umkehrbar.
LösungDurch die Spaltung der Esterbindung werden die Fettsäure-Reste frei. Diese tragen eine negative Ladung am Carboxylat-Ion $\left( \ce{-COO^-} \right)$. Das Kation der zur Spaltung eingesetzten Base lagert sich nun hier an. Der Fettsäure-Rest besitzt außerdem noch eine lange organische Kette. Diese ist unpolar, da sie nur aus Kohlenstoff- und Wasserstoffatomen besteht. Dieser Teil, auch als Schwanz bezeichnet, ist demnach hydrophob, also wasserabweisend, und lipophil (löslich in Fetten). Der Kopf dagegen trägt die negative Ladung und das Kation. Dieser Teil ist polar und damit hydrophil (wasserlöslich).
Diese Tenside können also zum Teil in polaren und zum anderen Teil in unpolaren Lösemittel gelöst werden. Sie sind daher grenzflächenaktiv. Sie lagern sich an der Phasengrenze dieser Lösemittel an. Dadurch ermöglichen sie ein Ablösen von unpolarem Schmutz im Lösemittel Wasser (Waschvorgang).
9.178
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.638
Lernvideos
35.583
Übungen
32.330
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation



 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?