Nitrocellulose
Cellulosenitrat, auch als Nitrocellulose bekannt, ist ein weißes, faseriges Biopolymer, das in Produkten wie Klebstoffen, Nitrolacken und als Raketentreibstoff verwendet wird. Lerne mehr über die Herstellung und Verwendung von Cellulosenitrat. Interessiert? Das und vieles mehr findest du im folgenden Text!
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Nitrocellulose
Nitrocellulose – Chemie
Sicher hast du auch schon Klebstoff verwendet. Darin kann Nitrocellulose enthalten sein. Diese Substanz wird auch für Raketentreibstoffe oder für die Herstellung von Tischtennisbällen verwendet. Doch weißt du auch, wie man Nitrocellulose herstellt? Das erfährst du in diesem Lerntext.
Was ist Nitrocellulose? – Definition
Der chemisch korrekte Name für das Biopolymer Nitrocellulose ist Cellulosenitrat. Aus diesem Grund werden wir im folgenden Text bei dem Namen Cellulosenitrat bleiben. Es handelt sich um eine wollähnliche, weiße, faserige, geruch- und geschmacklose Masse. Weitere Namen für Cellulosenitrat sind Schießbaumwolle oder Blitzwatte.
Weitere physikalische Eigenschaften von Cellulosenitrat kannst du in der folgenden Liste sehen:
- Dichte: $\pu{1,67 g//cm3}$
- Schmelzpunkt: $\pu{160-180 °C}$
- Aggregatzustand: fest
In der Chemie wird Cellulosenitrat mit folgender Strukturformel dargestellt:
Cellulosenitrat – Geschichte
Cellulosenitrat wurde im Jahr 1846 von Christian Schönbein und unabhängig davon im selben Jahr von Rudolf Böttger entdeckt. Im selben Jahr veröffentlichte Friedrich Otto das Verfahren zur Herstellung von Cellulosenitrat.
Gewinnung und Darstellung von Cellulosenitrat
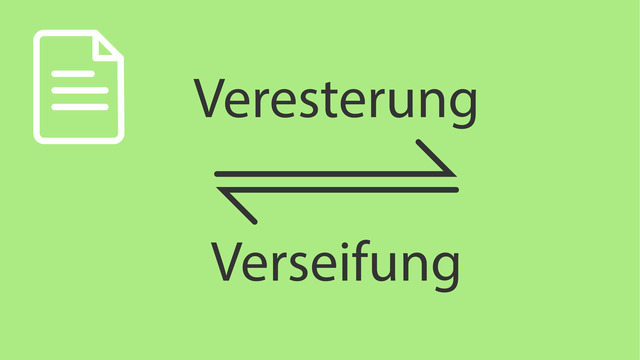
Die Herstellung von Cellulosenitrat findet über eine Nitrierung und Veresterung statt, bei der die Hydroxygruppen $(\ce{R-OH})$ der Cellulose zu Nitratgruppen $(\ce{R-O-NO2})$ umgesetzt werden und Wasser $(\ce{H2O})$ frei wird. Dies geschieht durch die Reaktion mit Nitriersäure, einem Gemisch aus Schwefelsäure $(\ce{H2SO4})$ und Salpetersäure $(\ce{HNO3})$. Die Umsetzung von der Cellulose zu Cellulosetrinitrat kannst du hier sehen:
Der Stickstoffgehalt des herzustellenden Cellulosenitrats wird durch Zusammensetzung der Nitriersäure und die Reaktionsdauer geregelt.
Bei einem Stickstoffgehalt $> 12,75\% $ handelt es sich dann überwiegend um Cellulosetrinitrat (Schießbaumwolle). Bei einem Stickstoffgehalt $< 12,75\% $ spricht man vom sogenannten Cellulosedinitrat (Kollodiumwolle).
Das Experiment zur Herstellung von Nitrocellulose
Als Erstes werden fünf Gramm Watte (Cellulose) eingewogen, die im Anschluss getrocknet werden. Ein Becherglas wird in eine Schüssel mit Eiswürfeln gestellt. In die Schüssel wird Kochsalz, also Natriumchlorid $(\ce{NaCl})$, hinzugefügt. Das Kochsalz sorgt dafür, dass der Gefrierpunkt erniedrigt wird. Deshalb wird die Mischung auch als Kältemischung bezeichnet.
Achtung: Es ist wichtig, hier unter einem Abzug zu arbeiten. In ein Becherglas wird die Salpetersäure $(\ce{HNO3})$ gegeben und unter Rühren die Schwefelsäure $(\ce{H2SO4})$ langsam hinzugemischt. Dabei entsteht Nitriersäure. Das ist ein Gemisch aus konzentrierter Salpeter- und konzentrierter Schwefelsäure.
Die eingewogene Watte wird in zwei Hälften geteilt und in kleinen Portionen der Nitriersäure hinzugefügt. Die Watte im Becherglas wird vorsichtig über 30 Minuten verrührt und gedrückt. Nun findet die Umsetzung der Cellulose zu Cellulosenitrat statt. Anschließend wird die überschüssige Nitriersäure dekantiert und die Watte mit der fünffachen Menge an Wasser ausgewaschen. Die Säure wird mit Natriumhydrogencarbonat $(\ce{NaHCO3})$ neutralisiert. Die Watte wird beispielsweise auf einer Heizung über mehrere Stunden getrocknet.
Nun kann eine kleines Stück der Watte mit einem Glimmspan berührt werden. Dabei verschwindet das Reaktionsprodukt vollständig. Die Verbrennung erfolgt ohne Sauerstoff $(\ce{O2})$ und Rauch. Bei der Verbrennung entstehen die Reaktionsprodukte Kohlenstoffmonoxid $(\ce{CO})$, Kohlenstoffdioxid $(\ce{CO2})$, Wasserdampf $(\ce{H2O})$ und Stickstoff $(\ce{N2})$.
Verwendung von Cellulosenitrat – Beispiele
Cellulosenitrat findet in einigen Produkten Verwendung. Allerdings gibt es zu Cellulosenitrat Sicherheitshinweise. Es ist explosionsgefährlich und kann bei Schlag, statischer Entladung und schnellem Erhitzen detonieren. Cellulosenitrat unterliegt außerdem dem deutschen Sprengstoffgesetz. Diese chemische Eigenschaft von Cellulosenitrat wird beispielsweise in Bergbausprengstoffen oder Raketentreibstoffen genutzt. Durch hinzufügen des Weichmachers Kampfer kann aus dem Cellulosenitrat der thermoplastische Kunststoff Zelluloid hergestellt werden. Zelluloid war früher ein Produkt, aus dem beispielsweise Puppen oder Träger für Filmmaterial hergestellt wurden. Die Produktion wurde jedoch wegen der bestehenden Feuergefährlichkeit eingestellt. Heutzutage bestehen Tischtennisbälle noch aus Zelluloid.
Wegen der Eigenschaften von Cellulosenitrat wird dieses in Klebstoffen, Nitrolacken oder für Membranuntersuchungen der DNA verwendet.
| Stoff | Verwendung |
|---|---|
| Cellulosenitrat | |
| Zelluloid (Kampfer und Cellulosenitrat) | |
Das Video Nitrocellulose
In diesem Video lernst du, wie man Nitrocellulose, auch Cellulosenitrat genannt, herstellt und wofür es verwendet wird. Du erfährst, dass es aufgrund der chemischen Eigenschaften des Cellulosenitrats ein großes Einsatzgebiet für die Verwendung gibt.
Im Anschluss an das Video und diesen Text findest du Übungsaufgaben, um dein erlerntes Wissen zu überprüfen. Viel Spaß!
Transkript Nitrocellulose
Hallo und ganz herzlich willkommen. In diesem Video geht es um die Nitrocellulose. So, wir beginnen mit einem Experiment. Zunächst wiege ich 5 Gramm Watte ein. Für den Versuch muss ich die Watte trocknen. In der Zwischenzeit: in eine kleine Plastikschüssel stelle ich ein größeres Becherglas hinein. Der Zwischenraum zwischen beiden wir mit Eiswürfeln ausgelegt. Darauf gebe ich gewöhnliches Kochsalz, so wie man es im Geschäft kaufen kann. Das nennt man eine Kältemischung, damit kann ich sehr gut kühlen. Von nun an werde ich eine Schutzbrille tragen. Jetzt werde ich zwei Säuren mischen, konzentrierte Salpetersäure und konzentrierte Schwefelsäure. Ich stelle Nitriersäure her. Zuerst gieße ich ein bestimmte Menge Salpetersäure in das Becherglas. Unter ständigem Rühren wird langsam Schwefelsäure hinzugefügt. Es ist ganz wichtig, entweder draußen oder unter einem Abzug zu arbeiten. Die eingewogene Watte teile ich in zwei Hälften. Den einen Teil der Watte gebe ich nun vorsichtig in die Nitriersäure. Wichtig sind kleine Portionen. Nun erfolgt ein vorsichtiges Rühren und Drücken der Watte in der Nitriersäure. Das dauert etwa 30 Minuten. Die überschüssige Nitriersäure wird dekantiert. Das Reaktionsprodukt, immer noch watteähnlich, wird nun mit Wasser gewaschen. Das sollte etwa fünfmal mit viel Wasser geschehen. Säurereste muss ich neutralisieren. Das geschieht mit Natriumhydrogencarbonat. Und wieder wird mehrfach mit Wasser gewaschen. Nun trockne ich das Reaktionsprodukt. Das dauert mehrere Stunden auf der warmen Heizung. Und das ist das Ergebnis. Ich nehme eine kleine Portion des Reaktionsprodukts ab und lege es in ein Becherglas. Der Stoff wird mit einem Glimmspan berührt. Es funktioniert, aber das Reaktionsprodukt ist verschwunden. Ich erkläre das Ergebnis. Watte besteht aus Cellulose. Daraus haben wir Nitrocellulose hergestellt. Die Reaktion heißt Nitrierung. Sie erfolgte mit konzentrierter Salpetersäure und konzentrierter Schwefelsäure. Der chemisch korrekte Name für Nitrocellulose ist Cellulosenitrat. Hergestellt wurde diese Verbindung erstmals durch den deutschen Chemiker Christian Friedrich Schönbein im Jahre 1846. Nitrocellulose nennt man umgangssprachlich Schießbaumwolle. Wie verläuft ihre Herstellung? Die Hydroxy-Gruppen der Cellulose werden zu Nitrat-Gruppen umgesetzt. An den Hydroxy-Gruppen O-H erfolgt durch die Nitriersäure eine Nitrierung. Es entstehen Nitrat-Gruppen O-NO2, oder kurz NO3. Die Nitrierung ist hier eine Veresterung. Neben der Nitrocellulose entsteht Wasser. Für das Cellulosemolekül sieht die Reaktion so aus. Die Verbrennung von Nitrocellulose läuft ungewöhnlich ab. Sie erfolgt auch ohne Sauerstoff. Es entsteht kein sichtbarer Rauch. Man spricht von einem rauchlosen Pulver. Bei der Reaktion entstehen Kohlenstoffmonoxid, Kohlenstoffdioxid, Wasserdampf und Stickstoff. Wofür verwendet man Nitrocellulose? Vor vielen Jahren stellte man eine Art von Kunstseide daraus her. Diese Art von Seite ist jedoch extrem feuergefährlich, daher hörte man auf, solche Seide herzustellen. Bedeutsam war die Erfindung von Zelluloid. Es besteht aus Nitrocellulose und aus Campher. Zelluloid ist feuergefährlich. Dennoch stellte man viele Jahre Spielzeugpuppen daraus her. Und noch viel länger bestanden Filme aus Zelluloid. Heute ist das nicht mehr so. Aber Tischtennisbälle werden nach wie vor aus Zelluloid gefertigt. Nitrocellulose ist beteiligt an Bergbausprengstoffen, an Raketentreibstoffen, am Treibstoff der Katjuschas, wie sie im Zweiten Weltkrieg von der Sowjetunion eingesetzt wurden. Außerdem verwendet man Nitrocellulose für Klebstoff. Bei der Membranuntersuchung der DNA und bei der Herstellung von Nitrolacken. Ich hoffe ihr hattet beim Schauen des Videos Vergnügen. Das war ein weiterer Film von André Otto. Ich wünsche euch alles Gute und viel Erfolg. Tschüss.
Nitrocellulose Übung
-
Erkläre die Reaktion der Herstellung von Nitrocellulose.
TippsÜberlege, an welchem Stoff sich die Hydroxygruppen befinden.
Für die Reaktion wird Nitriersäure verwendet. Überlege, wie die Reaktion dazu heißen könnte.
LösungBei der Herstellung von Nitrocellulose handelt sich um eine Nitrierungsreaktion. Die Cellulose besitzt Hydroxygruppen, wie im Bild dargestellt. Sie kann also formal als Polyalkohol betrachtet werden. Diese werden durch die Nitriersäure verestert. Eine Veresterung kann also nicht nur zwischen organischen Säuren und Alkoholen stattfinden, sondern auch zwischen anorganischen Säuren und Alkoholen.
Im Cellulosemolekül sind nun alle Hydroxygruppen durch Nitratgruppen ($NO_3$) ersetzt. Neben der Nitrocellulose bildet sich noch Wasser.
-
Nenne einige Verwendungsmöglichkeiten von Cellulosenitrat.
TippsNitrocellulose ist sehr explosiv.
Nitrocellulose kann als Bindemittel verwendet werden.
Cellulosenitrat hat schlechte Auswirkungen auf die Haut.
LösungAufgrund der explosiven Eigenschaften der Nitrocellulose wird es z.B. im Bergbau als Sprengmittel eingesetzt. Ein Vorteil ist die Raucharmut beim Sprengen, so kommt es in Höhlen zu einer geringeren Erstickungsgefahr.
Weiterhin wird es deshalb auch in der Raumfahrt als Produkt im Treibstoffmittel eingesetzt.
Cellulosenitrat ist außerdem ein sehr gutes Bindemittel, weshalb es z.B. in Klebstoffen und Farben zum Einsatz kommt.
Es stimmt, dass Stickstoff ein gutes Düngemittel ist, aber aufgrund der explosiven Eigenschaften der Nitrocellulose ist es für die Landwirtschaft ungeeignet.
-
Beschreibe die Versuchsdurchführung zur Herstellung von Nitrocellulose.
TippsWichtig ist zunächst die Masse des Ausgangsproduktes.
Im Anschluss muss zunächst die Nitriersäure hergestellt werden.
LösungBei der Herstellung von Nitrocellulose ist es wichtig, dass zunächst die Masse der Edukte bestimmt wird.
- Da Cellulose umgesetzt werden soll, wird also die Masse der Watte bestimmt.
- Für die Reaktion wird nun ein Kältebad hergestellt. Dieses verlangsamt die sehr starke Reaktion zwischen der Salpetersäure und der Schwefelsäure.
- Nach dem Mischen der beiden Säuren ist die benötigte Nitriersäure hergestellt.
- Anschließend wird die Watte Schritt für Schritt in die Nitriersäure getunkt.
- Die überschüssige Säure wird abdekantiert und aus dem Produkt gewaschen.
- Um das Produkt zu neutralisieren, wird es mit Natriumhydrogencarbonat gespült.
- Das Produkt wird erneut gewaschen und dann getrocknet.
-
Entscheide, bei welchem Molekül es sich um Nitrocellulose handelt.
TippsDer Ausgangsstoff Cellulose ist ein Polysaccharid.
Ein Polysaccharid ist dadurch gekennzeichnet, dass es aus n Monomereinheiten besteht.
Achte darauf, dass die Nitrocellulose die Nitratgruppen enthält.
LösungNitrocellulose erkennt man an der Cellulose-Grundstruktur, die anstelle von $-OH$-Gruppen $-O-NO_2$- Gruppen besitzt
Die erste Formel ist also die Strukturformel für Cellulosenitrat. Sie besitzt den Grundaufbau der Cellulose, an der die Hydroxygruppen der Cellulose durch die Nitrierung ersetzt wurden.
Auch Verbindung sechs ist ein Derivat der Cellulose. Hier sind die Hydroxygruppen allerdings durch Acetamidgruppen ersetzt. Es handelt sich hier um Chitin.
Wichtig ist, dass diese Verbindungen mit einer Klammer umgeben sind und ein n dahinter steht. Das zeigt, dass es sich um ein Polysaccharid handelt, also ein Kohlenhydrat, das aus mehreren kleinen Molekülen besteht.
Bei der dritten Formel handelt es sich um Glucose, der Grundbaustein der Cellulose. Beim vierten Bild handelt es sich um Nitrophenol, an einem Benzolring befinden sich eine Hydroxygruppe und eine Nitrogruppe. Die fünfte Verbindung zeigt Nitroglycerin. Das ist ein Sprengstoff, bei dem nicht Cellulose, sondern Glycerin nitriert wurde.
-
Bestimme das Säuregemisch, das für die Herstellung von Cellulosenitrat benötigt wird.
TippsBei der Reaktion zur Herstellung von Cellulosenitrat handelt es sich um eine Nitrierung.
LösungUm Cellulosenitrat (auch: Nitrocellulose) herzustellen, benötigt man konzentrierte Schwefelsäure und konzentrierte Salpetersäure. In einem Eisbad werden sie langsam miteinander vermischt. Es entsteht Nitriersäure. Dabei läuft folgende Reaktion ab:
$H_2SO_4 + HNO_3 \to {HSO_4}^- + {H_2NO_3}^+$
${H_2NO_3}^+ \to H_2O + {NO_2}^+$.Zunächst bildet sich ein Hydrogensulfat-Ion und ein sehr instabiles Ion, welches im nächsten Schritt in Wasser und in ein Nitronium-Ion zerfällt.
-
Erkläre die große Explosionskraft von Nitrocellulose.
TippsWelchen Aggregatzustand haben Kohlenmonoxid und Stickstoff?
Überlege, ob es bei einer Explosion zu einer Ausdehnung oder zu einem Zusammenziehen kommt.
LösungDer Grund, warum die Nitrocellulose so explosiv ist, liegt vor allem darin, dass sich ein Feststoff sehr schnell in Gase umwandelt. Es entstehen sehr viel Mole Gase wie z.B. Kohlenmonoxid, Kohlenstoffdioxid, Wasserdampf und Stickstoff, diese führen zu einem fünfmal so großen Gasvolumen. Die Gase brauchen Platz und das sehr schnell, weshalb es zu einer Explosion kommt. Nach der Explosion ist kein sichtbarer Rückstand mehr zu erkennen, weshalb man Nitrocellulose auch als rauchloses Pulver bezeichnet.
9.182
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.639
Lernvideos
35.583
Übungen
32.336
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation



 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?