Grundlagen der Elektrochemie
Nernst-Gleichung, Elektromotorische Kraft
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Elektrochemie in unserem Alltag
- Elektrodenpotential und elektrochemische Spannungsreihe
- Galvanische Zelle und Elektrolyse
- Elektromotorische Kraft
Elektrochemie in unserem Alltag
Das Leben der westlichen Welt wäre heutzutage ohne elektrischen Strom undenkbar. Immer mehr Geräte des täglichen Gebrauchs werden tragbar und unabhängig vom Stecker.
Grundlage vieler Speicher von elektrischer Energie ist die Elektrochemie. Batterien sind Anwendungen der galvanischen Zelle. In ihnen wird chemische Energie in elektrische umgewandelt. Beim Aufladen geschieht genau das Gegenteil, die Elektrolyse. Doch wie kommen diese Reaktionen zustande?
Elektrodenpotential und elektrochemische Spannungsreihe
Grundlage der Elektrochemie sind Redoxreaktionen. Dies sind Reaktionen mit Elektronenübergang.
Kommt eine Metallelektrode in Berührung mit einer Elektrolytlösung, bildet sich eine elektrochemische Doppelschicht aus. Es stellt sich ein Gleichgewicht zwischen Lösevorgang und Abscheidevorgang von Metall-Ionen ein. So entsteht das, für jedes Metall spezifische, Elektrodenpotential. Um diese Potentiale zu ordnen, wurde die Standard-Wasserstoff-Zelle entwickelt. Ihr Potential wurde willkürlich auf 0 V festgelegt.

Mit dieser Referenzelektrode war es nun möglich, eine Reihe aufzustellen, die elektrochemische Spannungsreihe. Hierbei wurden die Elektroden gegen die Standard-Wasserstoff-Zelle gemessen. So ergab sich eine Rangfolge, die unter anderem die Metalle in edel und unedel trennt. Mithilfe dieses Instruments ist es möglich, die Freiwilligkeit von Reaktionen zwischen Metallen und Metall-Ionen vorherzusagen.
Galvanische Zelle und Elektrolyse
Eine Elektrode in einer Elektrolytlösung bezeichnet man als Halbzelle. Es ist nun möglich, zwei Halbzellen miteinander zu verbinden. Dafür benötigt man eine stromleitende Verbindung und eine Salzbrücke. Einen solchen Aufbau nennt man galvanisches Element. Ein Beispiel für ein solches Element ist das Daniell-Element. Es besteht aus einer Zink- und einer Kupfer-Halbzelle.
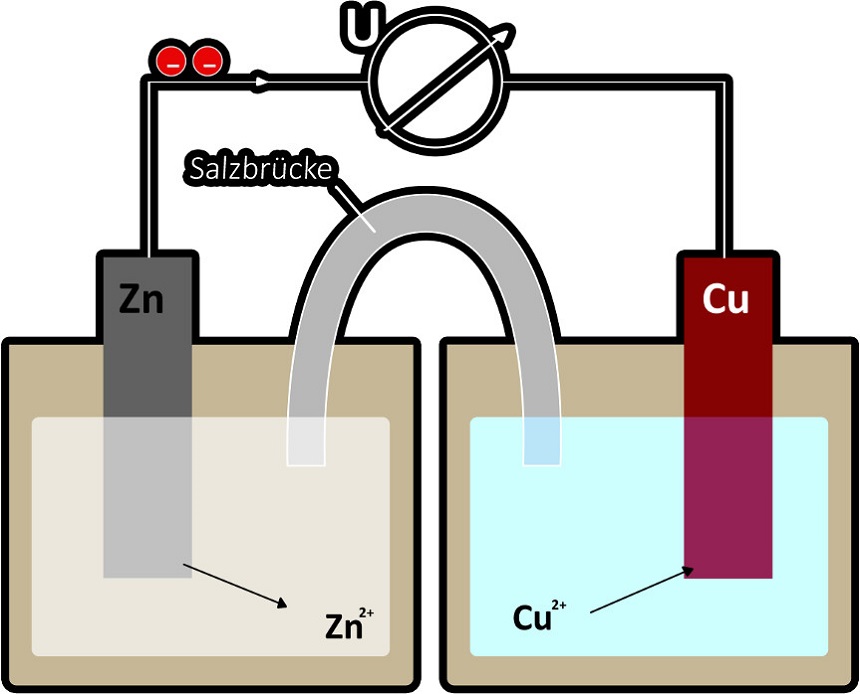
In einem galvanischen Element läuft die Reaktion freiwillig ab. Es wird chemische Energie in elektrische Energie umgewandelt. Dies macht man sich in Form von Batterien zunutze. So kann elektrische Energie überallhin mitgenommen werden.

Eine Batterie entlädt sich durch den Gebrauch. Irgendwann kommt die Reaktion zum Erliegen und der Strom hört auf zu fließen. Wenn du einen Akku benutzt hast, kannst du ihn jetzt aufladen. Diese Umkehrreaktion läuft nicht freiwillig ab. Sie muss also erzwungen werden. Man nennt sie Elektrolyse. Durch das Anlegen einer elektrischen Spannung kehrt man die Polung um und die Reaktionen verlaufen in die andere Richtung. Mithilfe der Elektrolyse können zum Beispiel unedle Metalle in Reinform gewonnen werden. Der Prozess wird als Schmelzflusselektrolyse bezeichnet.
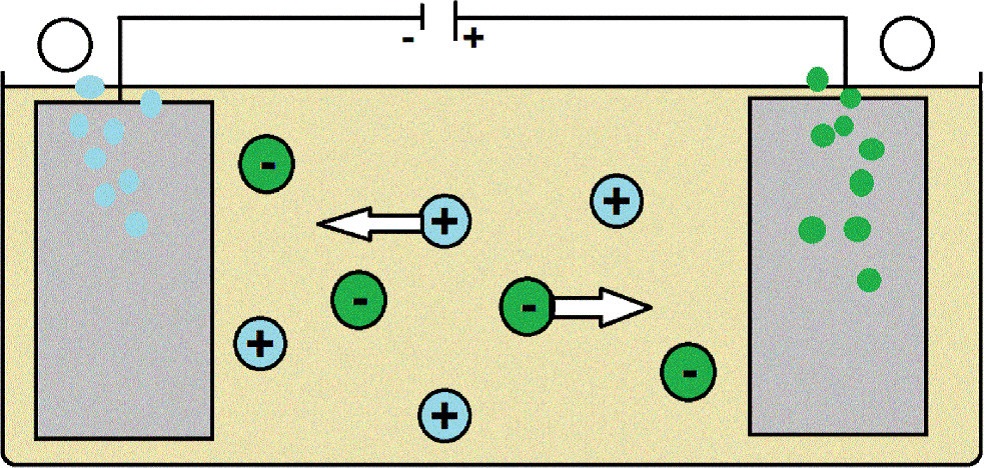
Elektromotorische Kraft
Die elektromotorische Kraft bezeichnet die Potentialdifferenz zwischen beiden Halbzellen einer galvanischen Zelle. Es ist also die elektrische Spannung, die zwischen den beiden herrscht. Die elektromotorische Kraft wird in Volt angegeben. Sie kann berechnet werden, indem das Potential der Anode vom Potential der Kathode subtrahiert wird. Auf diese Weise nimmt die Potentialdifferenz immer einen positiven Wert an.
![]()
Mithilfe der Elektrochemie ist es also unter anderem möglich, Reaktionen vorherzusagen, das Verhalten von Metallen zu erklären und unedle Metalle in Reinform zu gewinnen. Dies ist möglich aufgrund der elektrochemischen Spannungsreihe, der Standard-Wasserstoff-Zelle und der elektromotorischen Kraft.
Alle Videos zum Thema
Videos zum Thema
Grundlagen der Elektrochemie (10 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Grundlagen der Elektrochemie (9 Arbeitsblätter)
-
 Elektrochemische Spannungsreihe
PDF anzeigen
Elektrochemische Spannungsreihe
PDF anzeigen -
 Die Standardwasserstoffelektrode
PDF anzeigen
Die Standardwasserstoffelektrode
PDF anzeigen -
 Die elektrochemische Zersetzung von Wasser
PDF anzeigen
Die elektrochemische Zersetzung von Wasser
PDF anzeigen -
 Elektrodenreaktionen
PDF anzeigen
Elektrodenreaktionen
PDF anzeigen -
 Brennstoffzelle
PDF anzeigen
Brennstoffzelle
PDF anzeigen -
 Ionenwanderung in der galvanischen Zelle
PDF anzeigen
Ionenwanderung in der galvanischen Zelle
PDF anzeigen -
 Nernst-Gleichung und die Konzentrationsabhängigkeit des Elektrodenpotenzials
PDF anzeigen
Nernst-Gleichung und die Konzentrationsabhängigkeit des Elektrodenpotenzials
PDF anzeigen -
 Die Nernst-Gleichung – Einführung
PDF anzeigen
Die Nernst-Gleichung – Einführung
PDF anzeigen -
 Elektromotorische Kraft (EMK) und Elektrodenpotentiale
PDF anzeigen
Elektromotorische Kraft (EMK) und Elektrodenpotentiale
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation
























