Alkene
Alkene sind wichtige Edukte für die Polymerisation. Ihre Nomenklatur ist analog zu der der Alkane. Da die Doppelbindung der Alkene nicht drehbar ist, gibt es Isomerie.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Homologe Reihe der Alkene
Die Alkene sind wie die Alkane Kohlenwasserstoffe. Alkene besitzen aber eine oder mehrere Doppelbindungen zwischen jeweils 2 Kohlenstoffatomen. Das kleinste Alken ist das Ethen, früher auch als Ethylen bezeichnet.
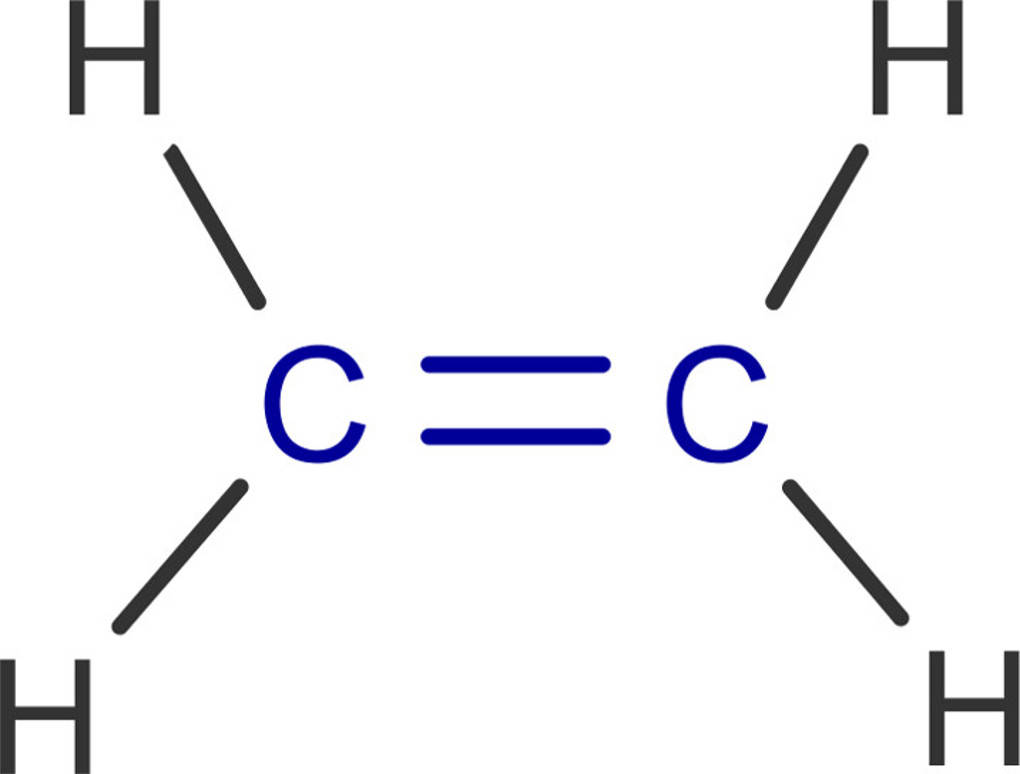
Alkene gehören durch die vorhandene Doppelbindung zu den ungesättigten Kohlenwasserstoffen. Die allgemeine Summenformel der Alkene lautet $C_nH_{2n}$. Die Nomenklatur der Alkene ähnelt stark der der Alkane. Die Anzahl der Kohlenstoffatome wird durch das jeweilige griechische Zahlwort beschrieben. Nur Methen ist nicht existent, da es keine 2 C-Atome gibt, zwischen denen eine Doppelbindung bestehen kann.
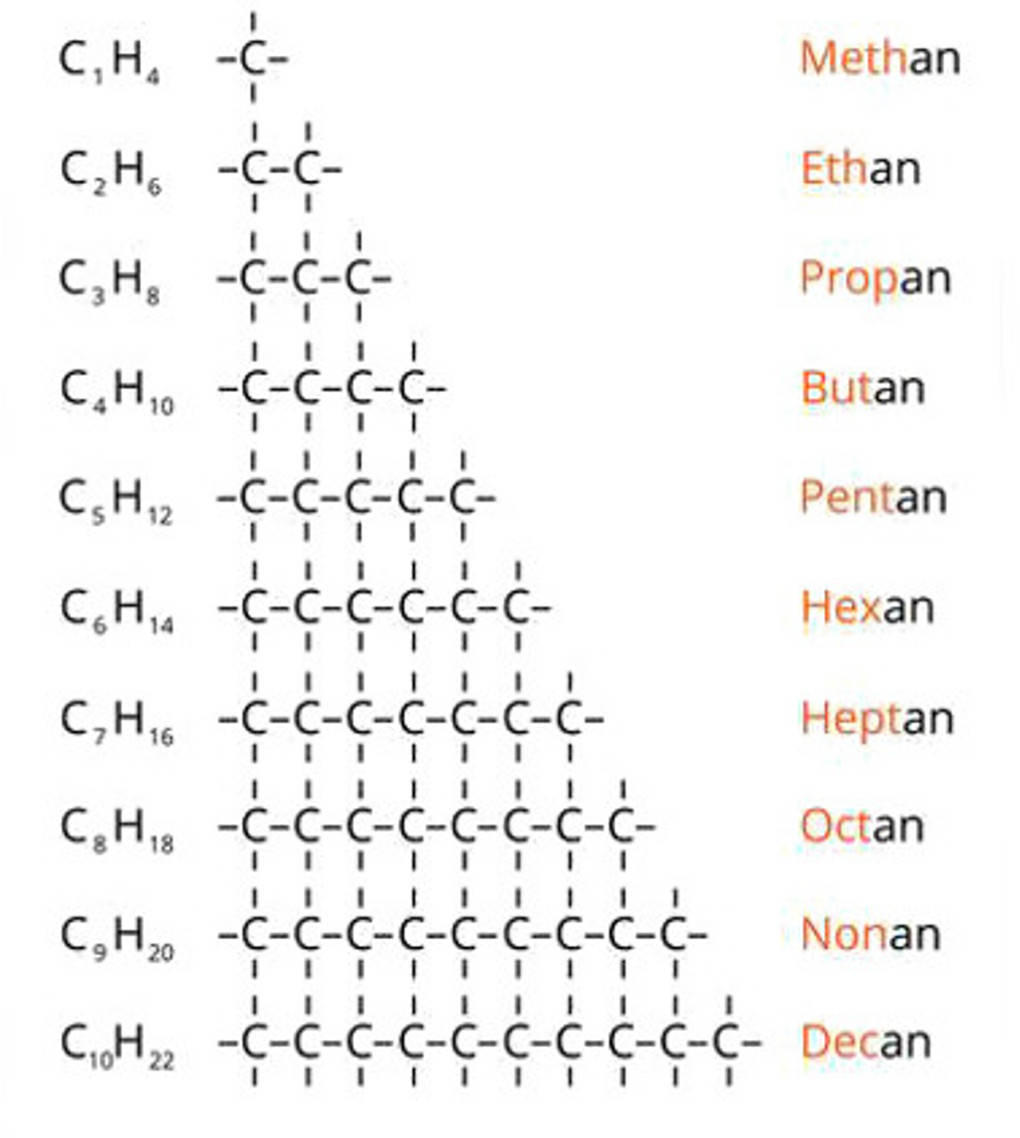
Es wird die längste Kette durchnummeriert, wodurch die Position der Doppelbindungen eindeutig beschrieben werden kann. Dabei gilt das Prinzip der kleinsten Zahl. D.h. die Richtung der Nummerierung muss so gewählt werden, dass die Positionen der Doppelbindungen mit den möglichst kleinsten Zahlen bezeichnet werden. Die Alkene erhalten die Endung -en. Bei mehreren Doppelbindungen erhält die Endung das entsprechende Zahlwort (di, tri, tetra usw.). Alkene sind wasserunlöslich und reaktionsfreudig. Die $\pi$-Bindung der Doppelbindung ist nur schwach und damit ein guter Angriffspunkt für eine Reaktion. Kurzkettige Alkene (1-4 C-Atome) sind gasförmig und leicht flüchtig. Ab 5 C-Atomen sind sie flüssig und ab 15 C-Atomen liegen sie bei Standardbedingungen als Feststoff vor. Alkene sind wichtige Ausgangsstoffe der chemischen Industrie zur Synthese vieler Produkte. So werden Alkohole, Halogenkohlenwasserstoffe, Waschmittelkomponenten und Kunststoffe aus ihnen hergestellt. Besonders oft werden dabei Ethen und Propen verwendet.
Isomerie der Alkene
Die Doppelbindung der Alkene ist im Gegensatz zur Einfachbindung nicht frei drehbar. Das bedeutet, es können sich je nach Stellung der Substituenten oder Kettenreste an der Doppelbindung Isomere bilden. Isomere sind Verbindungen, die gleiche Summenformeln aufweisen, sich in ihrer Struktur aber unterscheiden. Bei Alkenen kommt die cis-trans-Isomerie vor. Bezogen auf die Kettenreste bedeutet eine cis-Stellung, dass die ersten C-Atome der mit der Doppelbindung verbundenen Ketten auf derselben Seite stehen. Bei einer trans-Stellung stehen sie auf den gegenüberliegenden Seiten. Anhand von cis- und trans-Fettsäuren ist diese Isomerie gut erkennbar.
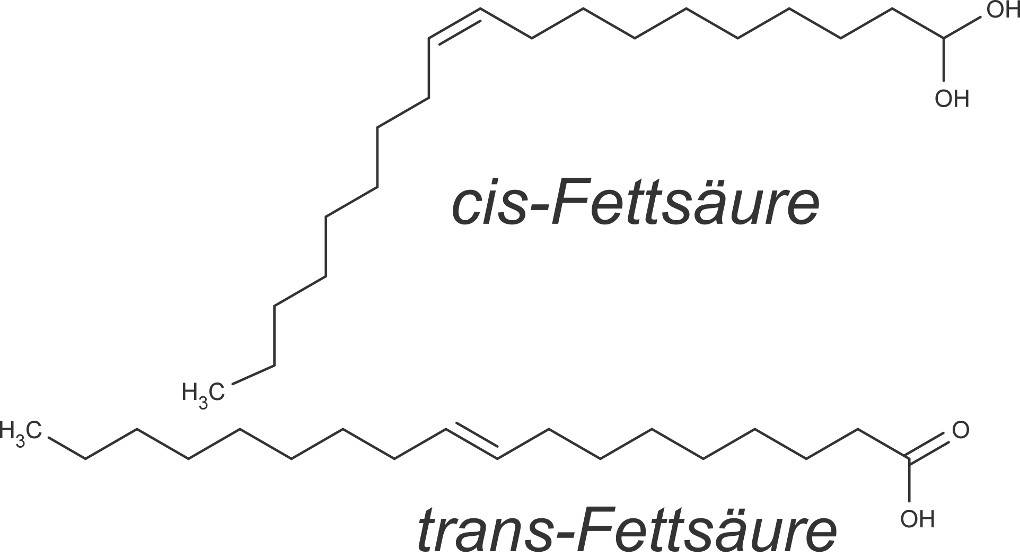
Die Isomere unterscheiden sich in ihren physikalischen als auch in den chemischen Eigenschaften. So sind z.B. Siedetemperatur und Reaktionsverhalten unterschiedlich. Identifiziert werden können die Isomere mittels IR-Spektroskopie oder mithilfe ihres Dipolmoments.
Reaktionen der Alkene
Eine typische Reaktionsart der Alkene ist die Addition. Genauer gesagt: die elektrophile Addition. Das bedeutet, dass Verbindungen die von negativen Ladungen angezogen werden, sogenannte Elektrophile, an das Alken addiert werden. Dabei wird kein anderer Stoff abgespalten, sondern es entsteht nur das Produkt. Die Doppelbindung der Alkene stellt einen Bereich mit hoher Elektronendichte dar. Dort sind also viele negative Ladungen konzentriert. Deswegen greifen Elektrophile genau dort an. Die $\pi$-Bindung der Doppelbindung ist besonders anfällig für solche Angriffe, da sie nicht sehr stark ist. Alkene und andere ungesättigte Verbindungen können auf diese Weise mit Halogenen reagieren. Dies nutzt man als Nachweis für ungesättigte Verbindungen in der Bromwasserprobe. Dabei wird Brom an die Doppelbindungen addiert und das Bromwasser entfärbt sich.
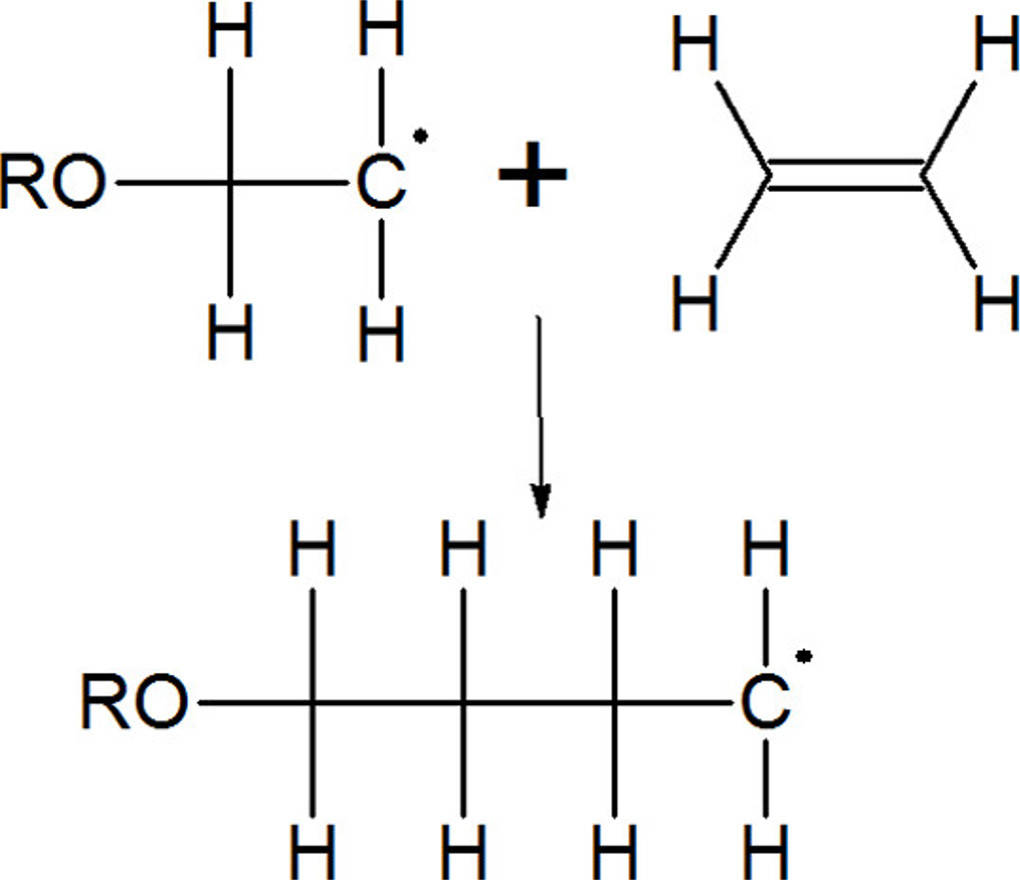
Bei der Addition von Halogenwasserstoffen gibt es 2 Möglichkeiten, an welches C-Atom das Halogen addiert wird. Wladimir Wassiljewitsch Markownikow entdeckte hier eine Gesetzmäßigkeit. Die Markownikow-Regel besagt, dass das Halogen-Atom sich an das C-Atom der Doppelbindung binden wird, welches die wenigsten Wasserstoff-Atome trägt. Es handelt sich also um das höher substituierte Kohlenstoffatom. Alkene können auch radikalisch reagieren. Dabei dient ein Radikal, ein Teilchen mit mindestens einem ungepaarten Elektron, als Reaktionsstarter. Die Doppelbindung wird aufgespalten, wodurch nun zwei neue Bindungen gebildet werden können. Auf diese Weise entstehen in mehreren Schritten lange Ketten.
Alle Videos zum Thema
Videos zum Thema
Alkene (7 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Alkene (5 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Cellulose Und Stärke Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation













 Alkene – Einführung
Alkene – Einführung
 Homologe Reihe der Alkene
Homologe Reihe der Alkene
 Alkene – Isomerie
Alkene – Isomerie
 Nomenklatur und Isomerie der Alkene
Nomenklatur und Isomerie der Alkene
 Alkene – Reaktionen
Alkene – Reaktionen









