Analyse des Atomaufbaus
Das Rutherford'sche Atommodell; Das Periodensystem; Atomaufbau; Linienspektren und Energieniveauschemata; Die Balmer Formel; Bohr'sches Atommodell: Berechnung der Bahnradien und der Energieniveaus des H-Atoms; Franck-Hertz-Experiment; Absorption von elektromagnetischer Strahlung durch Atome
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Modellbegriff und Analysemethoden
- Thomson’sches Atommodell
- Rutherford’sches Atommodell
- Bohr’sches Atommodell
Modellbegriff und Analysemethoden
Die Atome sind nicht mit den Augen oder optischen Hilfsmitteln zu sehen. Alle Erkenntnisse über sie wurden mit Experimenten erlangt. Mit diesen Erkenntnissen wurden immer wieder neue Modelle zur Beschreibung des Atomaufbaus entwickelt. Ein physikalisches Modell ist aber immer nur eine anschauliche Repräsentation der Wirklichkeit, so ist es beispielsweise passend, um die Energieverteilungen im Atom anzugeben, aber nicht um die Farbe eines Kernteilches widerzuspiegeln. Schon antike Gelehrte machten sich Gedanken zum Aufbau der Materie. So stammt das Wort Atom auch vom griechischen „atomos“ ab und bedeutet „das Unteilbare”.
Thomson’sches Atommodell
Was versteht man unter dem Thomson'schen Atommodell? Thomson schloss aus elektrostatischen Experimenten auf den Atomaufbau. Diese ließen für Thomson Rückschlüsse auf die gegenteiligen Ladungen in einem Atom zu, welche sich im Normalzustand genau aufhoben. Er benannte sie auch schon als positiv und negativ. Mit diesen Wissen schuf er das erste differenzierte neuzeitliche Atommodell. Nach diesem Modell bestehen Atome aus einem großen positiv geladenen Rumpf, dem Teig, in welchem die negativen Ladungen, die Rosinen, eingelagert waren. Wegen der bildlichen Vorstellung wurde das Modell auch „Rosinenkuchenmodell“ genannt.
Rutherford’sches Atommodell
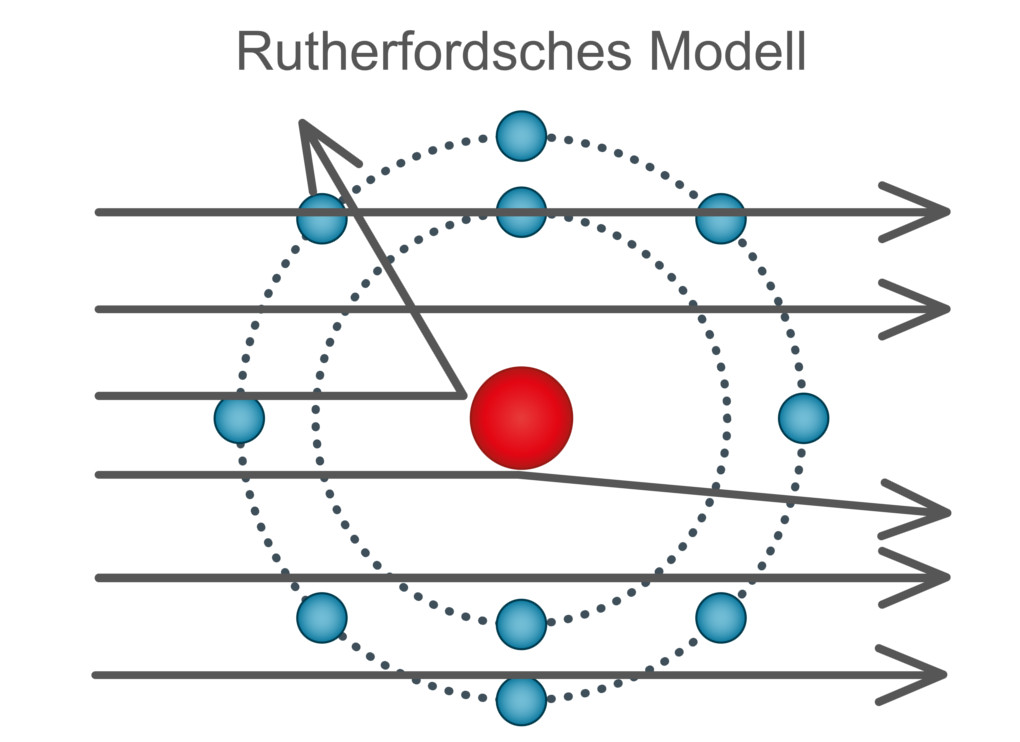
In seinem Streuversuch widerlegte Rutherford das Atommodell von Thomson. Ein für die Analyse des Atomaufbaus wesentlicher Schritt.

In diesem Versuch beschoss Rutherford eine dünne Goldfolie mit massereichen Alphateilchen und detektierte die Alphateilchen nach dem Auftreffen auf die Goldfolie mit einem Schirm. Er erwartete, dass die massereichen Alphateilchen die Goldfolie mühelos durchdringen und in gerader Linie hinter der Folie einschlagen würden. Die Alphateilchen wurden jedoch stark gestreut und abgelenkt.
Aus diesem Versuch konnte Rutherford viele Erkenntnisse gewinnen. Die Ablenkung der Alphateilchen konnte nur bedeuten, dass sich die positive Ladung des Atoms konzentriert an einer kleinen Stelle im Atom befinden musste. Da einzelne Alphateilchen reflektiert wurden, musste sich zudem die komplette Masse auch an einem kleinen Ort konzentrieren. Mit diesen Erkenntnissen schuf er das Kern-Hülle-Modell.
Atome bestehen nach diesem Modell aus einem kleinen, positiven und massereichen Atomkern und der großen, negativen und massearmen Atomhülle.
Auch das zweite Kernteilchen, das Neutron, postulierte Rutherford, ohne es jedoch nachweisen zu können.
Bohr’sches Atommodell
Die Spektroskopie von angeregten Atomen erbrachte wertvolle Erkenntnisse für den Atomaufbau. Das Vorhandensein von elementspezifischen Spektralinien zeigt, dass je nach Element nur konkrete Wellenlängen abgestrahlt wurden. Auch die Ionisierungsenergie, die benötigt wird, um ein Elektron von einem Atom zu trennen, war elementspezifisch. Zudem erbrachte auch der Franck-Hertz-Versuch genauere Erkenntnisse über die exakten Energiewerte bei den Elektronenübergängen in der Atomhülle. Mit diesen Erkenntnissen schuf Bohr sein Atommodell.
Das Bohr’sche Atommodell legt den Schwerpunkt auf den Aufbau der Elektronenhülle des Atoms. Die Elektronenhülle ist in energetische Schichten aufgeteilt. Diese kann man sich wie die Häute oder Schalen einer Zwiebel vorstellen. Die innerste Schale benannte Bohr mit K, nach außen hin geht es mit alphabetischer Reihenfolge weiter.
Auf jeder dieser Schalen haben unterschiedlich viele Elektronen Platz. Auf der K-Schale finden lediglich zwei Elektronen Platz, auf der L-Schale dagegen bereits acht Elektronen. Diese Schalen finden sich als Perioden auch im PSE wieder. Die äußerste Schale, auf der sich Elektronen befinden, ist die Valenzschale. Diese Schale ist für die Chemie von fundamentaler Bedeutung.

Die Analyse des Atomaufbaus ist damit jedoch nicht abgeschlossen. Durch die Erkenntnisse aus der Quantenphysik entwickelten sich noch weitere Atommodelle wie das Orbitalmodell.
Alle Videos zum Thema
Videos zum Thema
Analyse des Atomaufbaus (9 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Analyse des Atomaufbaus (9 Arbeitsblätter)
-
 Periodensystem der Elemente – Einführung in die Atomphysik
PDF anzeigen
Periodensystem der Elemente – Einführung in die Atomphysik
PDF anzeigen -
 Was ist ein Atom?
PDF anzeigen
Was ist ein Atom?
PDF anzeigen -
 Absorptions- und Emissionsversuche
PDF anzeigen
Absorptions- und Emissionsversuche
PDF anzeigen -
 Franck-Hertz-Versuch
PDF anzeigen
Franck-Hertz-Versuch
PDF anzeigen -
 Franck-Hertz-Versuch (Übungsvideo)
PDF anzeigen
Franck-Hertz-Versuch (Übungsvideo)
PDF anzeigen -
 Balmer-Formel
PDF anzeigen
Balmer-Formel
PDF anzeigen -
 Bohrsches Atommodell
PDF anzeigen
Bohrsches Atommodell
PDF anzeigen -
 Bohr'sches Atommodell (Basiswissen)
PDF anzeigen
Bohr'sches Atommodell (Basiswissen)
PDF anzeigen -
 Bohr'sches Atommodell (Expertenwissen)
PDF anzeigen
Bohr'sches Atommodell (Expertenwissen)
PDF anzeigen
Beliebteste Themen in Physik
- Temperatur
- Schallgeschwindigkeit
- Dichte
- Drehmoment
- Transistor
- Lichtgeschwindigkeit
- Galileo Galilei
- Rollen- Und Flaschenzüge Physik
- Radioaktivität
- Lorentzkraft
- Beschleunigung
- Gravitation
- Ebbe und Flut
- Hookesches Gesetz Und Federkraft
- Elektrische Stromstärke
- Elektrischer Strom Wirkung
- Reihenschaltung
- Ohmsches Gesetz
- Freier Fall
- Kernkraftwerk
- Was sind Atome
- Aggregatzustände
- Infrarot, Uv-Strahlung, Infrarot Uv Unterschied
- Isotope, Nuklide, Kernkräfte
- Transformator
- Lichtjahr
- Si-Einheiten
- Fata Morgana
- Gammastrahlung, Alphastrahlung, Betastrahlung
- Kohärenz Physik
- Mechanische Arbeit
- Schall
- Schall
- Elektrische Leistung
- Dichte Luft
- Ottomotor Aufbau
- Kernfusion
- Trägheitsmoment
- Heliozentrisches Weltbild
- Energieerhaltungssatz Fadenpendel
- Linsen Physik
- Ortsfaktor
- Interferenz
- Diode und Photodiode
- Wärmeströmung (Konvektion)
- Schwarzes Loch
- Frequenz Wellenlänge
- Elektrische Energie
- Parallelschaltung
- Dopplereffekt, Akustischer Dopplereffekt























